Notes
Article history
The research reported in this issue of the journal was funded by the HTA programme as project number 13/08/01. The contractual start date was in July 2013. The draft report began editorial review in January 2014 and was accepted for publication in August 2014. The authors have been wholly responsible for all data collection, analysis and interpretation, and for writing up their work. The HTA editors and publisher have tried to ensure the accuracy of the authors’ report and would like to thank the reviewers for their constructive comments on the draft document. However, they do not accept liability for damages or losses arising from material published in this report.
Declared competing interests of authors
Aileen Clarke is a member of the NIHR HTA Editorial Board.
Permissions
Copyright statement
© Queen’s Printer and Controller of HMSO 2015. This work was produced by Tsertsvadze et al. under the terms of a commissioning contract issued by the Secretary of State for Health. This issue may be freely reproduced for the purposes of private research and study and extracts (or indeed, the full report) may be included in professional journals provided that suitable acknowledgement is made and the reproduction is not associated with any form of advertising. Applications for commercial reproduction should be addressed to: NIHR Journals Library, National Institute for Health Research, Evaluation, Trials and Studies Coordinating Centre, Alpha House, University of Southampton Science Park, Southampton SO16 7NS, UK.
Chapter 1 Background
Description of health problem
Health problem
Crohn’s disease (CD), a form of inflammatory bowel disease (IBD), is a chronic relapsing–remitting condition that causes chronic inflammation of the gastrointestinal tract. CD can affect any part of the digestive tract, from the mouth to the anus. 1 Usually, CD involves both the superficial and deep layers of the intestine,2 and may be characterised by location (terminal ileal, colonic, ileocolic, upper gastrointestinal) and/or pattern of disease (inflammatory, perforating or stricturing). 3 The most frequently reported symptoms of CD include malnutrition, abdominal pain, diarrhoea, weight loss, fever and rectal bleeding.
The disease can occur at any age from early childhood to late adulthood. However, diagnosis is more common between the age of 15 and 25 years. Males and females are affected equally,4,5 and around one-third of people with CD are diagnosed before 21 years of age.
Aetiology of Crohn’s disease
The aetiology of CD is unknown. It is hypothesised that CD may result from interactions among genetic, immunological and environmental factors. 6 Smoking and genetic predisposition are the two important factors thought to play a key role in the aetiology of CD. 7
Clinical features of Crohn’s disease
The clinical course of CD is characterised by exacerbations and remission. 3 The clinical presentation depends on the part of the affected intestine and varies from mild to severe malnutrition, abdominal pain, diarrhoea, weight loss, fever and rectal bleeding. 5,8 The symptom pattern in children is different from that of adults and is characterised by anaemia, fever, growth failure and/or delayed puberty. 8
Diagnosis of Crohn’s disease
Initial assessment of patients with suspected CD includes history taking, physical findings and routine blood and stool tests. Further examinations, including plain abdominal radiographs, colonoscopy, flexible sigmoidoscopy, endoscopy or barium radiography, are also performed. The diagnosis of CD depends on the pathological findings of focal, asymmetrical, transmural or often granulomatous inflammation. Upper or lower gastrointestinal endoscopy should be performed to confirm the diagnosis of CD and assess disease location. 8–10
Prognosis of Crohn’s disease
Crohn’s disease is considered a serious disease which needs extensive and long-term treatment with continuous monitoring. 11 Quality of life (QoL) is reduced for CD patients during relapse, but patients with few relapses or with continuous mild symptoms manage to lead a normal life.
Crohn’s disease patients are affected not only physically, but also mentally (e.g. with depression), impacting on both their personal and professional lives. Patients with CD take more time off work and may change their time schedules at work as a direct result of their disease. 12–14 As the disease progresses, patients are at higher risk of developing complications such as strictures, perforation and/or fistula formation. About 50–80% of these patients may eventually require surgical interventions. 7
The mortality rate among patients diagnosed with CD has been shown to be greater for those diagnosed at an earlier age. For example, a study by Canavan et al. 14 reported a standardised mortality ratio (SMR) among CD patients and showed that younger patient had a worse prognosis than older patients [overall SMR 1.29, 95% confidence interval (CI) 1.12 to 1.45]. The SMR for patients aged 10–19 years was 16.95 (95% CI 14.99 to 18.91), compared with a SMR of 0.92 (95% CI 0.65 to 1.19) for patients aged 75 years or older. Compared with the general population, mortality among patients with CD is also significantly higher in the first 3 years after diagnosis and in those who have had the disease for 13 years or more. Actual cause of death could be anything directly related to the disease or as a consequence of the disease such as surgery, malnutrition, colorectal cancer, electrolytes imbalance or massive haemorrhage. 13,14
Epidemiology of Crohn’s disease
Crohn’s disease has become an important health threat in the West and industrialised countries. 15 The areas with the highest incidence rate are the UK, North America and northern Europe. 16 The annual incidence of CD in Europe and North America has been increasing over time and is estimated to be around 2–8 per 100,000 population. Similarly, the prevalence of the disease in the Western world has been estimated to be approximately 60 per 100,000. 4
In the UK, CD is one of the most common causes of gastrointestinal morbidity. In the north of England and Scotland, more recent estimates of the prevalence of CD indicate it to be between 145 and 157 per 100,000. 17 Scotland has a higher incidence rate than London and Wales. In the UK, there are currently at least 115,000 people with CD. 7
Approximately 80% of CD patients will require surgery over their lifetime. 18 Between 1990 and 2000, the rate of hospital admissions rose from 7648 to 8834 in England (16% increase). The age-standardised admission rate for CD increased from 15.5 to 17.6 per 100,000 (14% increase) over the same period. The hospital admission rate (in 1999–2000) was higher in females than in males, with a female to male ratio of 1.5 to 1.0. However, according to age-specific admission rates, the hospital admission rate was higher for the 25–34 years age group, with a more equal distribution between males and females. 19
Impact of Crohn’s disease
Crohn’s disease typically affects people during their economically productive adult life and many require life-long medical and surgical interventions over several decades. The financial burden due to the management of CD is very large. 20 Bassi et al. 21 reported a detailed microcosting analysis of costs of illness for IBD in inner-city patients for the UK NHS. Using hospital records, the authors identified and followed up 479 patients who had received some form of secondary care for IBD for up to 6 months. The mean 6-month cost per patient for CD was found to be £1652 (95% CI £1221 to £2239). Similarly, costs for ambulatory and hospitalisation groups were £516 (95% CI £452 to £618) and £6923 (95% CI £5415 to £8919), respectively. 21
Measurement of disease
The most widely used tool for characterising the activity (i.e. severity) of CD is the Crohn’s Disease Activity Index (CDAI). 8,22 Patients with a CDAI score of < 150 points are often classified as having a quiescent or non-active (i.e. in remission) form of disease. A CDAI score of ≥ 150 points is indicative of an active form of the disease. 22 CDAI is also used in conjunction with additional parameters/markers such as erythrocyte sedimentation rate (ESR) and C-reactive protein (CRP). 23
Current service provision
Management of Crohn’s disease
According to the current National Institute for Health and Care Excellence (NICE) guideline,7 the management of CD consists of smoking cessation, treatment with drugs, nutritional support and surgery (in severe or chronic cases). The aim of treatment is mainly to reduce symptoms by inducing and maintaining remission so that QoL improves. 7
The treatment of CD can be categorised as non-surgical and surgical.
-
Non-surgical interventions include:
-
smoking cessation
-
pharmacological [corticosteroids, biologics, aminosalicylates, immunosuppressants, tumour necrosis factor (TNF) inhibitors, antibiotics]
-
nutritional (enteral feeding, restricted diet, parenteral feeding) alone or as an adjuvant therapy.
-
-
Endoscopic/surgical interventions (indicated for complications such as bowel obstruction, high-grade dysplasia, abscess, internal fistulas and cancer).
The treatment is chosen after considering a balance between individual response in terms of beneficial effects, treatment-related adverse events and long-term complications. 23,24 Corticosteroids are most widely used drugs for the management of active CD; however, their use is associated with high risk of relapse, low rates of mucosal healing, steroid dependency and other adverse events (e.g. growth impairment in children, increased risk of infection). There have been safety concerns with long-term use of other agents such as TNF inhibitors. 1 A summary of the CD treatment guidelines recommended by NICE7 is provided in Box 1.
-
Offer monotherapy with a conventional glucocorticosteroid (prednisolone, methylprednisolone or intravenous hydrocortisone) to induce remission in people with a first presentation or a single inflammatory exacerbation of CD in a 12-month period.
-
Consider enteral nutrition as an alternative to a conventional glucocorticosteroid to induce remission for children in whom there is concern about growth or side effects and young people in whom there is concern about growth.
-
In people with one or more of distal ileal, ileocaecal or right-sided colonic disease who decline, cannot tolerate or in whom a conventional glucocorticosteroid is contraindicated, consider budesonide for a first presentation or a single inflammatory exacerbation in a 12-month period.
-
In people who decline, cannot tolerate or in whom glucocorticosteroid treatment is contraindicated, consider 5-aminosalicylate for first presentation or a single inflammatory exacerbation in a 12-month period.
-
Do not offer budesonide or 5-ASA treatment for severe presentations or exacerbations.
-
Do not offer azathioprine, MP or methotrexate as monotherapy to induce remission.
-
Consider adding azathioprine or MP to a conventional glucocorticosteroid or budesonide to induce remission of CD if there are two or more inflammatory exacerbations in a 12-month period, or if the glucocorticosteroid dose cannot be tapered.
-
Assess TPMT activity before offering azathioprine or MP. Do not offer azathioprine or MP if TPMT activity is deficient (very low or absent). Consider azathioprine or MP at a lower dose if TPMT activity is below normal but not deficient (according to local laboratory reference values).
-
Consider adding methotrexate to a conventional glucocorticosteroid or budesonide to induce remission in people who cannot tolerate azathioprine or MP, or in whom TPMT activity is deficient, if there are two or more inflammatory exacerbations in a 12-month period, or if the glucocorticosteroid dose cannot be tapered.
-
Infliximab and adalimumab are recommended as treatment options for adults with severe active CD who have not responded to conventional therapy (including immunosuppressive and/or corticosteroid treatments), or who are intolerant of or have contraindications to conventional therapy. Infliximab or adalimumab should be given as a planned course of treatment until treatment failure (including the need for surgery), or until 12 months after the start of treatment, whichever is shorter. People should then have their disease reassessed to determine whether or not ongoing treatment is still clinically appropriate.
-
Consider surgery as an alternative to medical treatment early in the course of the disease for people whose disease is limited to the distal ileum. Take into account benefits/risks of medical treatment, surgery risk of recurrence after surgery, individual preferences and personal/cultural considerations.
-
Consider surgery early in the course of the disease or before, or early in puberty for children and young people whose disease is limited to the distal ileum and who have growth impairment despite optimal medical treatment and/or refractory disease.
-
Offer azathioprine or MP as monotherapy when previously used with a conventional glucocorticosteroid or budesonide to induce remission.
-
Consider azathioprine or MP in people who have not previously received these drugs (particularly those with adverse prognostic factors such as early age at onset, perianal disease, glucocorticosteroid use at presentation and severe presentations).
-
Consider methotrexate only in people who needed methotrexate to induce remission or who have tried but did not tolerate azathioprine or MP for maintenance or who have contraindications to azathioprine or MP.
-
Do not offer a conventional glucocorticosteroid or budesonide to maintain remission.
-
Consider azathioprine or MP in people with more than one resection or previously complicated or debilitating disease (e.g. abscess, involvement of adjacent structures, fistulising or penetrating disease).
-
Consider 5-ASA treatment.
-
Do not offer budesonide or enteral nutrition.
5-ASA, 5-aminosalicylic acid; MP, mercaptopurine; TPMT, thiopurine methyltransferase.
Description of technology under assessment
Summary of intervention
Enteral nutrition has played an important but controversial role in the alleviation of malnutrition and control of disease activity in patients with active CD. Enteral nutrition formulas vary in the protein and fat content and are classified as elemental (amino acid), semi-elemental (oligopeptide), polymeric (whole protein) or specialised diet. 25,26 Enteral nutrition is a method of delivering nourishment through a tube placed in the nose (nasogastric or nasoenteral tube), the stomach (gastrostomy or percutaneous endoscopic gastrostomy tube), or the small intestine (jejunostomy or percutaneous endoscopic jejunostomy tube).
Elemental nutrition is a liquid formula that contains individual amino acids, glucose polymers and is low in fat, with approximately 2–3% of calories derived from long-chain triglycerides (LCTs). In many elemental products, medium-chain triglycerides are the main fat source and are absorbed directly across the small intestinal mucosa into the portal vein in the absence of lipase or bile salts. Semi-elemental nutrition contains peptides of various chain lengths, simple sugars, glucose polymers or starch and fat. Polymeric nutrition contains intact proteins, complex carbohydrates and mainly LCTs. Specialised nutritional formulas contain biologically active substances or nutrients such as glutamine, arginine, nucleotides or essential fatty acids. 26,27
The mechanism of action of enteral nutrition on CD is not known. Several hypothesised mechanisms underlying the proposed benefits of enteral nutrition in CD include reduced gut activity, reduction of antigenic load, nutritional effects, anti-inflammatory effects or modulation of immune system and gastrointestinal flora. 28–31
Types and route of administration
-
As exclusive enteral nutrition (EEN): provided especially as a sole dietary source and a primary medical therapy to induce remission.
-
As partial enteral nutrition (PEN): given additionally to normal unrestricted/restricted diet, to improve nutritional status and/or to maintain remission.
Both EEN and PEN may be administered either orally or with nasogastric tube. 32
Enteral nutrition as induction therapy
There is some evidence of clinical benefit and long-term safety of enteral nutrition in inducing remission in patients, especially children and young adults with active CD33,34 and in maintaining the remission of quiescent CD. 28 For example, in Japan, enteral nutrition is recommended as the first-line treatment in the management of active CD. 31,35 It has also been recommended by the European Society of Parenteral and Enteral Nutrition as first-line therapy in children and young adults with concerns about growth and side effects if corticosteroid therapy is not appropriate. 36 Although enteral nutrition has been shown to be an effective and safe intervention for induction of remission in patients with active CD, withdrawal from enteral nutrition and resumption of normal diet would often be followed by recurrence of gastrointestinal symptoms and use of corticosteroids. 30 Evidence comparing clinical effectiveness of enteral nutrition to corticosteroids for the induction of remission has been inconsistent, with one meta-analysis showing no difference between the two34 and a more recent meta-analysis indicating a superiority of corticosteroids over enteral nutrition. 25
Enteral nutrition as maintenance therapy
The National Institute for Health and Care Excellence recommends that enteral nutrition should not be used as maintenance therapy after surgery. 7 Moreover, use of enteral nutrition as maintenance therapy is challenging owing to compliance issues. 1 Most evidence on the comparative clinical effectiveness of enteral nutrition in the maintenance of CD remission rests on retrospective observational cohort studies and prospective non-randomised controlled experimental trials. 1,3,15
Evidence of the efficacy of different types of enteral nutrition (i.e. elemental, semi-elemental, polymeric) in maintaining remission in CD has been insufficient and less clear. 1,3,4,15 Specifically, only two systematic reviews evaluated effectiveness of elemental nutrition in maintaining remission for patients with CD. 30,35 The Cochrane review, published in 2009, included only two randomised controlled trials (RCTs). 30 The other review by Yamamoto et al. 35 published in 2010 included one RCT, three non-randomised controlled trials (nRCTs) and six retrospective cohort studies. This review did not provide formal assessment of methodological quality of individual studies. None of the two reviews attempted to summarise data on cost-effectiveness of elemental diet. Moreover, since 2010, studies with more recent evidence may have been published. Given the above, a new systematic review of clinical effectiveness and cost-effectiveness of elemental nutrition for the maintenance of remission in CD is clearly warranted.
Chapter 2 Definition of the decision problem
Decision problem
Crohn’s disease is a chronic relapsing–remitting inflammatory disease affecting the gastrointestinal tract. 1 Currently, none of the available therapeutic options (e.g. medical, surgical or nutritional) leads to complete cure of CD. The management of the disease usually involves the induction and then maintenance of remission of disease activity by controlling the extent of inflammatory process, correcting malnutrition and reducing symptoms as well as the occurrence of complications. 23,24 In children, the additional aim of the treatment is to promote healthy growth and development.
Enteral nutrition is one of the available treatment options in the management of CD and has been shown to be beneficial in inducing remission and improving nutritional status in adults and children diagnosed with active CD. 29,35 There is less clarity of the role of enteral nutrition in maintaining remission in patients with quiescent CD. The available evidence is insufficient or inconclusive and needs to be updated. 30,35
If enteral nutrition is at least as effective as standard medical treatments, it could potentially replace or minimise the use of steroids and/or other pharmaceutical agents, thereby preventing the occurrence of adverse events, complications, steroid dependence and growth retardation in both adults and children with CD.
The objective of this systematic review was to identify, appraise and evaluate the evidence on clinical effectiveness and cost-effectiveness of elemental nutrition for the maintenance of remission in CD.
Overall aims and objectives of assessment
-
To evaluate the clinical effectiveness and cost-effectiveness of elemental nutrition administered alone or in combination with other interventions (e.g. diet, standard drug treatment) compared with other intervention(s) (e.g. placebo, diet, standard drug treatment) for maintaining remission in patients with CD.
-
To compare the clinical effectiveness and cost-effectiveness of elemental nutrition with other types of enteral nutrition (semi-elemental, polymeric nutrition), duration and dose with regards to maintaining remission and adherence.
-
To explore subgroup effects of elemental nutrition on maintenance of remission (i.e. risk of relapse or recurrence). Specifically, to examine if the treatment effect of elemental nutrition varies across groups defined by gender (males, females), age (adults, adolescents and children) and type of induction therapy (medically, nutritionally, surgically induced).
-
To evaluate additional outcomes for patients with CD such as adherence to elemental nutrition, CDAI, incidence of mucosal healing, QoL, adverse events, gain in body weight [or body mass index (BMI)], growth and pubertal development.
Chapter 3 Methods
The review protocol is registered on PROSPERO International prospective register of systematic reviews (CRD42013005134; available from www.crd.york.ac.uk/PROSPERO/display_record.asp?ID=CRD42013005134). 37
Search strategies
Using an iterative procedure, an experienced librarian developed the search strategy with input from clinical advisors and previous systematic reviews. 30,35,38
Comprehensive electronic searches were conducted to identify all references relating to elemental nutrition; maintenance of remission; and CD. Searches were undertaken in MEDLINE (Ovid), MEDLINE In-Process & Other Non-Indexed Citations (Ovid), EMBASE (Ovid), The Cochrane Library – all sections (Wiley Online Library), Science Citation Index and Conference Proceedings (Web of Knowledge), World Health Organization International Clinical Trials Registry Platform (WHO ICTRP) and UK Clinical Research Network (UKCRN) Study Portfolio. The databases were searched from 1947 to August/September 2013; the actual data range for each of the databases searched depended on the coverage of the individual database. The electronic searches were not limited by study design, language or publication date.
Citation searches of included studies were undertaken using the Web of Science citation search facility.
Two supplementary database searches using limits were undertaken. The first, combining CD with the concept of nutrition therapy and limited to systematic reviews or cost-effectiveness, aimed to capture any articles that included the assessment question as part of a broader systematic review or cost study. The second, combining CD with the concept of elemental nutrition and limited to relevant study types, aimed to capture any articles that involved the current included population (see Study inclusion criteria) as part of a controlled clinical trial (CCT) of both active CD and CD in remission.
The websites of organisations such as Crohn’s and Colitis UK (previously the National Association for Colitis and Crohn’s Disease),5 Crohn’s nutricia39 and Crohn’s in Childhood Research Association40 were also checked.
In addition, experts in the field were contacted and references of included studies were also checked for potentially relevant studies.
All the retrieved records were collected in a specialised database and duplicate records were identified and removed.
Details of the electronic search strategies used for the review of the clinical effectiveness are given in Appendix 1.
Study inclusion criteria
Type/language of publication
English full text and abstracts (only if companion publications to full-text included studies).
Study design
Both RCTs and non-randomised CCTs. For types of economic evaluation studies, trial-based as well as modelling studies of observational design were eligible for inclusion.
Population
Adults, young people or children with CD in remission (inactive, quiescent CD) at the time of study baseline.
Main intervention
Elemental nutrition alone via oral passage, nasal passage (nasogastric tube, nasojejunal tube, nasoduodenal tube), or direct passage via the abdomen (gastrostomy tube, jejunostomy tube).
Elemental nutrition in combination with other intervention(s) (e.g. standard drug therapy any other type of treatment).
Comparator
Enteral nutrition (elemental, semi-elemental or polymeric nutrition) alone, normal unrestricted/restricted diet alone (i.e. no intervention), standard drug therapy alone, any other intervention or placebo.
Enteral nutrition (elemental, semi-elemental or polymeric nutrition) in combination with other intervention(s) (e.g. standard drug therapy, any other intervention or placebo).
Standard drug therapy in combination with any other intervention and/or placebo.
Study exclusion criteria
-
Induction studies (patients with active CD at baseline) with or without follow-up of remitted patients continuing to receive maintenance therapy.
-
Studies of parenteral (intravenous) nutrition.
-
Studies of ulcerative colitis.
-
Studies employing non-concurrent (e.g. historical) controls.
-
Studies with mixed patient populations (< 80% CD).
-
Studies comparing different formula/diets of elemental nutrition.
-
Reviews (systematic or non-systematic), meta-analyses, observational cohort studies, case-reports, case-series, editorials, abstracts or comments.
Outcomes of interest
Outcomes: clinical effectiveness
Adult populations
-
Maintenance of remission [% patients in remission at end of follow-up, cumulative probability of maintaining remission (Kaplan–Meier estimate of survival) and duration of remission] – primary outcome.
-
Development of relapse/recurrence [proportion of patients developing relapse/recurrence (n/N), time to relapse/recurrence (mean number of months)] – primary outcome.
-
Incidence of mucosal healing (n/N) – primary outcome.
-
Need for surgery (n/N) – secondary outcomes.
-
Withdrawal from steroids (n/N) – secondary outcome.
-
Steroid dose tapering (n/N) – secondary outcome.
-
CDAI score (mean end point or mean change from baseline) – secondary outcome.
-
Health-related quality of life (HRQoL) (mean score: end point or mean change) – secondary outcome.
-
Adverse events (n/N) – secondary outcome.
-
Complications of CD (n/N) – secondary outcome.
-
Gain in body weight or BMI (mean change in kg or kg/m2) – secondary outcome.
-
Adherence (n/N) – secondary outcome.
Younger populations (e.g. adolescents, paediatric)
-
Maintenance of remission [% patients in remission at end of follow-up, cumulative probability of maintaining remission (Kaplan–Meier estimate of survival) and duration of remission] – primary outcome.
-
Development of relapse/recurrence [proportion of patients developing relapse/recurrence [n/N], time to relapse/recurrence (mean number of months)] – primary outcome.
-
Incidence of mucosal healing (n/N) – primary outcome.
-
Need for surgery (n/N) – secondary outcome.
-
Withdrawal from steroids (n/N) – secondary outcome.
-
Steroid dose tapering (n/N) – secondary outcome.
-
CDAI score (mean end point score or mean change score from baseline).
-
HRQoL (mean score: end point or mean change) – secondary outcome.
-
Adverse events (n/N) – secondary outcome.
-
Complications of CD (n/N) – secondary outcome.
-
Gain in body weight or BMI (mean change in kg or kg/m2) – secondary outcome.
-
Adherence (n/N) – secondary outcome.
-
Growth (mean change score/any growth measure from baseline) – secondary outcome.
-
Pubertal development – secondary outcome.
Outcomes: cost-effectiveness
-
Costs (no efficacy measures: cost-minimisation analysis).
-
Costs and efficacy measures: clinical and quality-adjusted life-years (full economic analysis).
-
Incremental cost-effectiveness ratios (full economic analysis).
-
Results from cost-effectiveness acceptability curves.
Study selection strategy
Two independent reviewers using a pre-piloted screening form screened all identified bibliographic records for title/abstract. Full-text reports of all potentially relevant records were then retrieved and examined independently. Disagreements were resolved via discussions and consensus agreement (either between the two reviewers or via a third party).
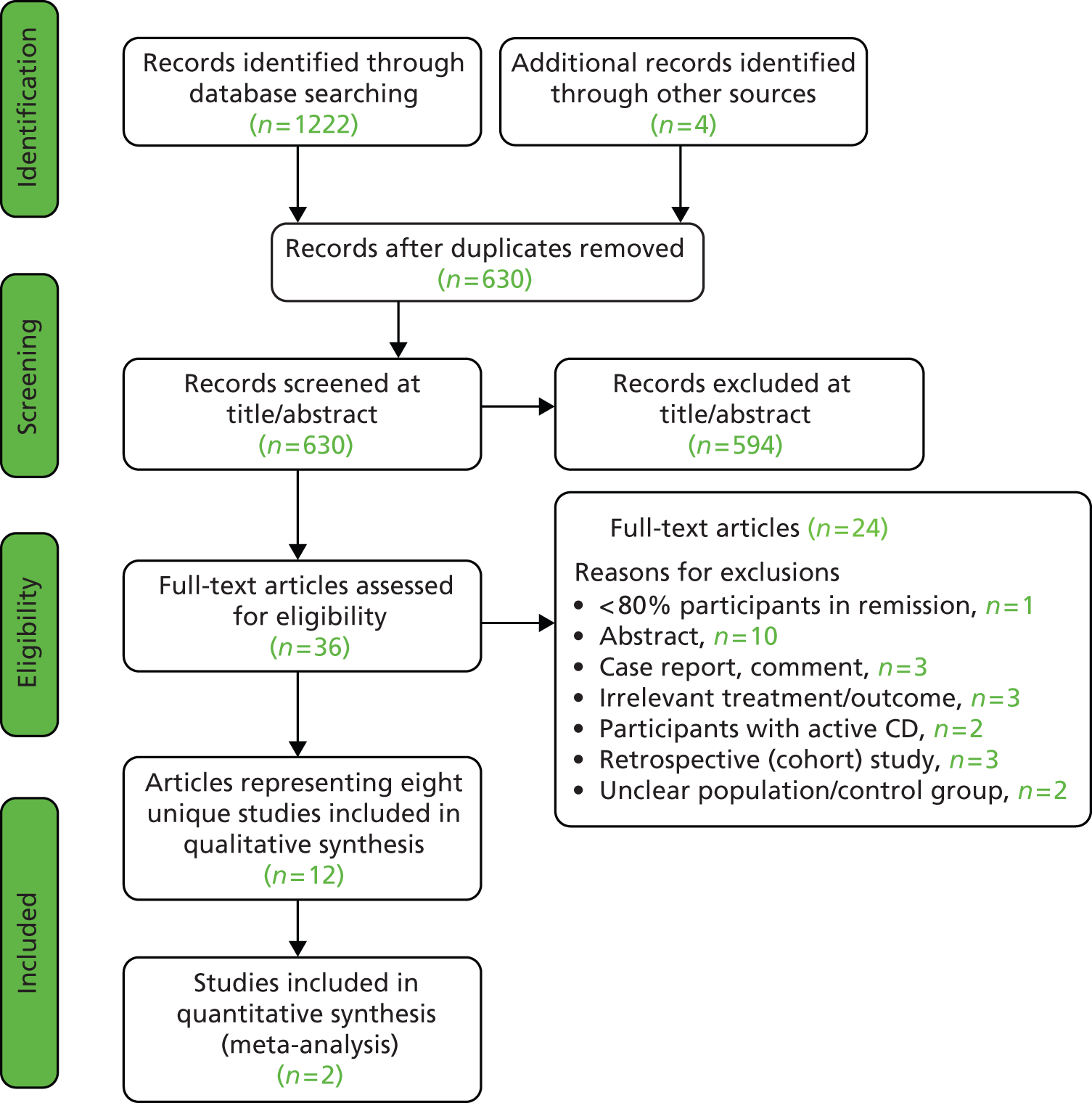
The study flow and reasons for exclusion of full-text papers were documented in the Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) study flow diagram (see Figure 1). 41
Data extraction strategy
Two reviewers independently extracted relevant data using a pre-defined pre-piloted extraction sheet (see Appendix 2). The extracted data included details about study [e.g. author, country, design, sample size, follow-up duration, risk of bias (RoB) items], participant (e.g. age, gender, inclusion/exclusion criteria, CD activity index, clinical/endoscopy definitions of CD remission, type of induction therapy), intervention/comparator (brand name/manufacturer of elemental nutrition, type, mode, duration and dose of administration of elemental nutrition, any concomitant diet or dietary restriction, and other co-intervention such as medications), and outcome characteristics (e.g. type and scale of measurement, timing of assessment, definition of CD relapse/recurrence). The extracted data were cross-checked by a second reviewer and any disagreements were resolved by discussion. Further discrepancies were resolved by a third reviewer, if necessary.
For individual studies, the dichotomous and continuous summary clinical effectiveness outcome measures of association were summarised as risk ratio (RR)/odds ratio (OR), mean difference (MD) and measures of variability (p-value, 95% CI). We tried to calculate missing statistical parameters [e.g. RRs, MDs, standard deviations (SDs), standard errors and 95% CIs] for clinical outcomes of interest (e.g. maintenance of remission, risk of relapse, time to relapse, incidence of mucosal healing, need for surgery, withdrawals, adherence, adverse events and complications). All calculated parameters were entered into the data extraction sheets and marked as ‘calculated’.
Risk of bias assessment strategy
Two reviewers independently assessed the methodological and reported quality of included individual studies. Any disagreements between the two reviewers were resolved by a third reviewer through discussion.
The RCTs were quality-assessed using the Cochrane Collaboration RoB tool42 which covers the following domains of threat to internal validity: selection bias (randomisation sequence generation, treatment allocation concealment), performance bias (blinding of participants/personnel), detection bias (blinding of outcome assessors), attrition bias (incomplete outcome data primary outcome), reporting bias (selective outcome/analysis reporting) and other pre-specified bias (e.g. funding source, adequacy of statistical methods used, type of analysis, baseline between-group imbalance in important prognostic factors).
The RoB assessment falls into three categories of high, low and unclear RoB. The assessments were provided in RoB tables and summary graphs. Non-randomised CCTs were assessed using a modified Cochrane RoB tool in which the domain of selection bias was evaluated in regards to baseline between-group imbalance for important prognostic factors instead of randomisation sequence generation and treatment allocation concealment. For each study (RCT or nRCT), the risk of performance, detection and attrition bias domains for subjective (e.g. patient-administered clinical or QoL scores) and objective outcomes (e.g. additional laboratory criteria used in the definition of remission/relapse, weight gain, mucosal healing, growth, adverse events) were assessed separately. Afterwards, within-study summary risk of bias (SRoB) ratings across all domains were derived for subjective and objective outcome groups separately. At data synthesis stage, across-study average SRoB ratings were determined and assigned to each outcome of interest (see Appendix 3).
The quality of economic analyses of the included studies was planned to be assessed using the Drummond 10-item checklist. 43
Data synthesis
Study, treatment, population and outcome characteristics were summarised in text and summary tables. The study results on the relative clinical effectiveness of elemental nutrition for each outcome of interest were compared qualitatively and quantitatively in text and summary tables.
In the clinical effectiveness part of the review, results for any given outcome measure were presented separately stratified by a comparison category: (1) elemental nutrition compared with no intervention (i.e. restricted/unrestricted diet alone), (2) elemental nutrition compared with drug (standard therapy), (3) elemental nutrition compared with combination of elemental and drug, (4) elemental nutrition combination with drug compared with drug alone, and (5) elemental nutrition compared with other type of enteral nutrition.
The decision to pool individual study results was based on a degree of similarity with respect to methodological and clinical characteristics of studies under consideration (e.g. design population, comparator treatment and outcome). Estimates of post-treatment MD for continuous outcomes and RRs for binary outcomes (except for rare events) of individual studies were pooled using a DerSimonian and Laird random-effects model. 44 Dichotomous outcomes with low event rates (5.0–10.0%) were pooled as RR using a Mantel–Haenszel fixed-effects model. Dichotomous outcomes for studies with very low event rates (≤ 5.0%) or zero events in one of the treatment arms were pooled as OR using a Peto fixed-effects model. 45 Trials were not pooled if the mean and/or SD for the continuous outcome of interest could not be ascertained.
The degree of statistical heterogeneity across pooled studies was determined through inspection of the forest plots, Cochran’s Q and the I2 statistics. The heterogeneity was judged according to predetermined levels of statistical significance (chi-square-based p < 0.10 and/or I2 > 50%). If data allowed, study-level clinical and methodological sources of heterogeneity of effect estimates across studies was explored through a priori defined subgroup analysis (i.e. age, gender, induction therapy) and sensitivity analysis (RoB item-specific ratings, intention-to-treat compared with per protocol analysis).
Given a sufficient number of data points, publication bias was planned to be assessed through visual inspection of funnel plots with respect to plot asymmetry and use of linear regression tests. 46
Results for individual studies were rendered inconclusive in cases of missing/partially reported data (e.g. missing/undetermined summary effect measures and/or corresponding 95% CIs, only p-value reported) or statistically non-significant effect estimates with great uncertainty (i.e. wide intervals that include moderate-to-large effect size treatment effects in both directions compatible to either benefit or harm of elemental nutrition).
Overall quality of evidence (Grading of Recommendations, Assessment, Development, and Evaluation system)
The overall quality of evidence for pre-selected gradable outcome (maintenance of remission, risk of CD relapse/recurrence, mucosal healing, need for surgery, adherence and adverse events) across studies was assessed using the systematic approach developed by the Grading of Recommendations, Assessment, Development and Evaluation (GRADE) Working Group (www.gradeworkinggroup.org). 47
The GRADE approach48 indicates level of confidence in the observed treatment effect estimate(s) and is based on assessments across five domains: (1) SRoB across studies per gradable outcome (internal validity across studies, study limitations), (2) consistency of results (heterogeneity), (3) directness of the evidence (applicability of the results), (4) precision of the results (the width of 95% CI around the estimate) and (5) publication/reporting bias (detection of asymmetry in the funnel plot, selective outcome reporting). The overall quality of evidence was rated as high, moderate, low or very low grade. Initial grade of RCTs was rated as high and downgraded by one point (e.g. from high to moderate) if any of the five criteria were not met. Initial grade for nRCTs was to be rated as low and upgraded by one point (e.g. from low to moderate) if any of the three criteria for upgrading a grade were met (e.g. dose–response gradient, large magnitude of effect and adjustment for confounders). 49
Chapter 4 Results
Literature search
A total of 1222 records were identified through electronic searches. Four additional records were identified from other sources and the removal of duplicates left 630 records to be screened, of which 594 were excluded at title/abstract level as obviously irrelevant. The full text of the remaining 36 records was examined, of which 12 (representing eight unique studies) were included in the review. 28,50–60
Of the eight included studies, one RCT52–54 and one nRCT28,59,60 were represented in multiple publications. Throughout this review, these two studies will be cited according to their corresponding original publications. 28,52
The search of on-going trials in the UKCRN Portfolio and WHO ICTRP databases, which includes Clinical Trials.gov and Current Controlled Trials, (carried out in September 2013), retrieved 26 potentially relevant records, none of which was deemed relevant for inclusion in the review.
The study flow diagram outlining the process of identifying relevant literature and eight included studies28,50–52,55–58 along with reasons for exclusion is given in Figure 1. More details on exclusions can be found in Appendix 4.
FIGURE 1.
Study flow diagram.
Trial characteristics
This review included three RCTs50,52,55 and five nRCTs. 28,51,56–58
Randomised controlled trials
The study and participant characteristics of the three included RCTs50,52,55 are summarised in Table 1. Of three RCTs, two were conducted in Japan50,52 and one in the UK. 55 A total of 179 participants were randomised across three RCTs with individual trial sample size ranging from 3355 to 9550 participants. The mean age of participants across the three trials ranged from 2952 to 44 years55 and the proportion of females from 23%52 to 68%. 55 The length of follow-up of the studies ranged from 1252,55 to 24 months. 50 In most participants, CD was located in both the small and large intestines. Induction therapies included parenteral nutrition,50,52 central venous feeding,50 prednisolone,50,55 infliximab,50,52 6-mercaptopurine (6-MP),50 enteral nutrition52 or surgery. 52 Only two studies52,55 reported criteria used for the diagnosis of CD. The diagnosis of CD included clinical, endoscopic, radiological and/or histological criteria.
| Study and country | Study details | Inclusion/exclusion criteria | Interventions | Patient characteristics | |||
|---|---|---|---|---|---|---|---|
| Elemental nutrition | Control 1 | Control 2 | |||||
| Hanai 201250 Japan | Aim: to evaluate the efficacy of elemental diet and 6-MP vs. no intervention as maintenance therapy in CD | Inclusion criteria: aged ≥ 18 years who achieved remission (CDAI score of < 150 points) within 30 days of entry to this trial | Elemental nutrition: Elental (Ajinomoto Pharmaceutical Ltd., Tokyo, Japan) at ≥ 900 kcal/day, taken via self-inserted feeding tube (two patients) or by oral intake (32 patients) | Patients randomised (n) | 32 | 30 | 33 |
| Exclusion criteria: patients with abdominal abscess, stricture (B1 of Vienna and Montreal classification), pregnant women, patients with cardiovascular disorders and history of intolerance to 6-MP | Restricted diet: patients were allowed an intake of 3.5–4.0 kcal/kg/day from food as recommended by a qualified dietitian | Age (years), mean (SD) | 30.1 (7.7) | 32.5 (8.9) | 29.8 (10.3) | ||
| Study setting: specialty clinic | Control 1: drug (6-MP 20–80 mg/day). Unrestricted normal diet | Gender (female), n/N (%) | 10/32 (31.2) | 7/30 (23.3) | 8/33 (24.2) | ||
| Length of follow-up (months): 24 | Control 2: no intervention. Unrestricted normal diet | Weight (kg), mean (SD) | NR | NR | NR | ||
| Funding: NR | BMI (kg/m2), mean (SD) | NR | NR | NR | |||
| Smoking, n/N (%) | 18/32 (56.2) | 15/30 (50.0) | 18/33 (54.5) | ||||
| Duration of CD (months), mean (SD) | 73.2 (69.6) | 67.2 (80.4) | 58.8 (75.6) | ||||
| CDAI score (points), mean (SD) | 103.4 (21.4) | 93.2 (27.8) | 89.9 (30.1) | ||||
| Location of CD, n/N (%) | |||||||
| Ileocolic type | 19/32 (59.4) | 21/30 (70.0) | 19/33 (57.6) | ||||
| Ileal type | 8/32 (25.0) | 8/30 (26.7) | 11/33 (33.3) | ||||
| Colic type | 3/32 (9.4) | 2/30 (6.7) | 3/33 (9.1) | ||||
| Previous bowel resection, n/N (%) | NR | NR | NR | ||||
| Type of induction therapy [n (%)]: parenteral nutrition [70/95 (73.7)], central venous feeding [25/95 (26.3)], prednisolone [9/95 (9.5)], infliximab [4/95 (4.2)], 6-MP [14/95 (14.7)] | |||||||
| Total number who received induction therapy: NR | |||||||
| Total number who achieved remission after induction therapy: 105 | |||||||
| Total number allocated to maintenance treatment: 95 | |||||||
| Diagnostic criteria used for CD: NR | |||||||
| Co-interventions: 5-ASA (2250–3000 mg/day), sulphasalazine (3000 mg/day) | |||||||
| Outcome definitions applied: remission (CDAI score of < 150 points), relapse/recurrence (CDAI score of ≥ 200 points or the need for an additional medication to suppress worsening symptoms) | |||||||
| Outcomes reported: maintenance of remission, risk of relapse, adverse events, complications, need of surgery | |||||||
| Takagi 2006;52,53 Takagi 200954 Japan | Aim: to compare relapse rates in patients with inactive CD receiving half elemental nutrition (elemental nutrition + unrestricted diet) vs. no intervention (unrestricted diet) | Inclusion criteria: CD patients if they had just undergone induction of remission | Elemental nutrition: Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) through a self-inserted tube and/or oral intake. Patients took half the amount of their daily allowance of calories by elemental nutrition and the remaining half by usual unrestricted meals | Patients randomised (n) | 26 | 25 | |
| Study setting: specialty clinic | Exclusion criteria: NR | Control: no intervention; patients took all nutrients via their usual un-restricted meals | Age (years), mean (SD) | 30.8 (11.1) | 28.9 (8.1) | ||
| Length of follow-up (months): 12 | Gender (female), n/N (%) | 6/26 (23.1) | 8/25 (32.0) | ||||
| Funding: no external funding received | Weight (kg), mean (SD) | NR | NR | ||||
| BMI (kg/m2), mean (SD) | 20.1 (3.1) | 20.0 (3.6) | |||||
| Smoking, n/N (%) | NR | NR | |||||
| Duration of CD (months), mean (SD) | 49.2 (50.4) | 67.2 (78.0) | |||||
| CDAI score (points), mean (SD) | 101.8 (34.1) | 86.4 (31.3) | |||||
| Location of CD, n/N (%) | |||||||
| Small bowel only | 8/26 (30.7) | 7/25 (28.0) | |||||
| Colon only | 3/26 (11.5) | 6/25 (24.0) | |||||
| Both | 15/26 (57.7) | 12/25 (48.0) | |||||
| Previous bowel resection, n/N (%) | 11/26 (42.3) | 11/25 (44.0) | |||||
| Type of induction therapy [n (%)]: elemental enteral nutrition 22/51 (43.1) (1800–2100 kcal/day) for 6–8 weeks; total parenteral nutrition 25/51 (49.0) (1500–2100 kcal/day) for 6–8 weeks; oral/i.v. prednisolone 1/51 (2.0) (40 mg/day, then tapered every 2 weeks by 5–10 mg); 5 mg/kg i.v. infliximab 3/51 (5.9), and/or surgery [5/51 (7.9)] | |||||||
| Total number who received induction therapy: 82 | |||||||
| Total number who achieved remission after induction therapy: 56 | |||||||
| Total number allocated to maintenance treatment: 51 | |||||||
| Diagnostic criteria used for CD: clinically, endoscopically, radiologically and/or histologically (diagnostic criteria as defined by the Ministry of Health, Labour and Welfare of Japan) | |||||||
| Co-interventions: mesalazine (2250–3000 mg/day), azathioprine (50 mg/day) | |||||||
| Outcome definitions applied: remission (CDAI score of < 150 points), relapse/recurrence (CDAI score of > 200 points, or the need for therapy to induce remission) | |||||||
| Outcomes reported: risk of relapse, HRQoL, adherence | |||||||
| Verma 200155 UK | Aim: to compare safety and efficacy of elemental and polymeric nutrition for the maintenance of remission, risk of relapse and intolerance | Inclusion criteria: inactive CD and steroid dependency for maintaining clinical remission and two previous unsuccessful attempts to withdraw steroid that prompted recurrence during or after 30 days of withdrawal | Elemental nutrition: orally taken (EO28 Extra, Nutricia Ltd, Trowbridge, UK); sachets containing powdered feed mixed with tap water (20 g/100 ml); the mean daily intake 730 kcal (range 600–1017 kcal). Unrestricted normal diet | Patients randomised (n) | 19 | 14 | |
| Study setting: specialty clinic | Exclusion criteria: recurrent small-bowel obstruction due to Crohn’s strictures, significant sepsis including perianal disease, previous intolerance to enteral feeding or unwilling to give formal written consent | Control: orally taken polymeric nutrition (Fortisip, Nutricia Ltd, Trowbridge, UK); ready-to-drink cartons (200 ml); the mean daily intake 730 kcal (range 600–1017 kcal). Unrestricted normal diet | Age (years), mean (SD) | 41.7 (5.4) | 44.1 (3.2) | ||
| Length of follow-up (months): 12 | Gender (female), n/N (%) | 13/19 (68.4) | 9/14 (64.3) | ||||
| Funding: NR | Weight (kg), mean (SD) | 62.4 (3.4) | 71.4 (7.7) | ||||
| BMI (kg/m2), mean (SD) | 21.8 (1.2) | 24.4 (1.6) | |||||
| Smoking, n/N (%) | NR | NR | |||||
| Duration of CD (months), mean (SD) | 154.4 (37.2) | 123.6 (26.4) | |||||
| CDAI score (points), mean (SD) | 106.4 (14.9) | 90.4 (17.8) | |||||
| Location of CD, n/N (%) | |||||||
| Small bowel | 7/19 (36.8) | 6/14 (42.8) | |||||
| Large bowel | 4/19 (21.0) | 4/14 (28.6) | |||||
| Mixed anastomotic | 2/19 (10.5) | 0/14 (0.0) | |||||
| Previous bowel resection, n/N (%) | NR | NR | |||||
| Type of induction therapy [n (%)]: prednisolone [33 (100)] | |||||||
| Total number who received induction therapy: NR | |||||||
| Total number who achieved remission after induction therapy: NR | |||||||
| Total number allocated to maintenance treatment: 33 | |||||||
| Diagnostic criteria used for CD: standard clinical, radiological, endoscopic and histological criteria | |||||||
| Co-interventions: steroids/prednisolone (6.5–7.1 mg), azathioprine (dose: NR), 5-ASA (dose: NR) | |||||||
| Outcome definitions applied: remission (absence of diarrhoea and abdominal pain, CDAI score of ≤ 150 points in the 2 weeks preceding the study and ESR < 20 mm/hour); relapse/recurrence (CDAI score of ≥ 200 points or increased by 100 points from baseline) | |||||||
| Outcomes reported: maintenance of remission, risk of relapse, adherence, withdrawal from steroids | |||||||
In all three trials, the elemental nutrition was given in addition to unrestricted diet (i.e. normal/free diet) through self-inserted feeding tube50,52 or oral intake. 50,52,55 In one trial,52 participants in the elemental nutrition group were asked to take half of the daily calories through elemental nutrition (i.e. ‘half-elemental diet’) and the other half from unrestricted diet. Participants in the control groups were assigned to receive unrestricted diet (no intervention),50,52 drug (6-MP)50 or polymeric nutrition. 55
Remission was defined using CDAI score of ≤ 150 points either alone or with additional clinical criteria (e.g. absence of diarrhoea and abdominal pain or ESR < 20 mm/hour). 55 Similarly relapse was defined as either a CDAI score of ≥ 200 points alone or with additional criteria (e.g. the need for an additional medication to suppress worsening symptoms,50,52 CDAI score increase by 100 points from baseline). 55
Non-randomised controlled trials
The study and participant characteristics of the five included nRCTs28,51,56–58 are summarised in Table 2. Of five studies, four were conducted in Japan28,51,57,58 and one in the UK. 56 A total of 236 participants were assigned to the study treatments and the number of participants across the studies ranged from 3956 to 61. 51 The mean age in the studies ranged from 2251 to 42 years56 and the proportion of females from 13%51 to 72%. 56 The length of follow-up ranged from 1228,57 to 48 months. 51 One trial included exclusively those participants who had previously undergone bowel resection surgery for CD. 28 The majority of participants had both small and large bowel involvement of CD. Only one study reported the diagnostic criteria of CD,51 and induction therapies were prednisolone,56,57 azathioprine,56 5-aminosalicylic acid (5-ASA),28,56,57 infliximab,57,58 corticosteroid,28 bowel resection,28 parenteral nutrition57 and elemental nutrition. 51,57
| Study and country | Study details | Inclusion/exclusion criteria | Interventions | Patient characteristics | ||||
|---|---|---|---|---|---|---|---|---|
| Elemental nutrition | Control 1 | Control 2 | Control 3 | |||||
| Hirakawa 1993,51 Japan | Aim: to compare the effects of elemental nutrition alone, combination of elemental nutrition and drugs, drugs alone, and no intervention on maintenance of remission in CD patients | Inclusion criteria: patients with CD in remission | Elemental nutrition: elemental nutrition (brand: NR) via nasoenteral tube (with restricted diet) | Patients assigned (n) | 25 | 22 | 8 | 6 |
| Study setting: primary care | Exclusion criteria: patients with active CD | Control 1: elemental nutrition + drug (sulfasalazine 3 g/day or prednisolone 10 mg/day) (with restricted diet) | Patients analysed (n) | 22 | 17 | 8 | 6 | |
| Length of follow-up (months): 48 | Control 2: drug (sulfasalazine 3 g/day or prednisolone 10 mg/day) (with restricted diet) | Age (years); mean (SD) | 27.0 (7.4) | 26.6 (2.4) | 21.9 (2.6) | 25.7 (5.0) | ||
| Funding: NR | Control 3: no intervention (with restricted diet) | Gender (female), n/N (%) | 3/22 (13.6) | 6/17 (35.3) | 3/8 (37.5) | 2/6 (33.3) | ||
| Weight (kg), mean (SD) | NR | NR | NR | NR | ||||
| BMI (kg/m2), mean (SD) | NR | NR | NR | NR | ||||
| Smoking, n/N (%) | NR | NR | NR | NR | ||||
| Duration of CD (months), mean (SD) | NR | NR | NR | NR | ||||
| CDAI score (points), mean (SD) | 61.6 (29.2) | 56.0 (26.6) | 68.5 (30.2) | 69.3 (52.1) | ||||
| Location of CD, n/N (%) | ||||||||
| Small bowel | 5/22 (22.7) | 0/17 (0.0) | 0/8 (0.0) | 0/6 (0.0) | ||||
| Large bowel | 1/22 (4.5) | 3/17 (17.6) | 2/8 (25.0) | 0/6 (0.0) | ||||
| Small and large bowel | 16/22 (72.7) | 14/17 (82.3) | 6/8 (75.0) | 6/6 (100.0) | ||||
| Previous bowel resection, n/N (%) | NR | NR | NR | NR | ||||
| Type of induction therapy [n (%)]: elemental nutrition [25/53 (47.1)], elemental nutrition and drugs [23/53 (43.4)], drugs alone [5/53 (9.4)] | ||||||||
| Total number who received induction therapy: 84 | ||||||||
| Total number who achieved remission after induction therapy: 67 | ||||||||
| Total number allocated to maintenance treatment: 61 | ||||||||
| Diagnostic criteria used for CD: criteria of the Japanese Society of Gastroenterology | ||||||||
| Co-interventions: NR | ||||||||
| Outcome definitions applied: remission IOIBD score (value: NR) and normal values of ESR and CRP, relapse/recurrence of subjective/objective symptoms (increase of the IOIBD score by ≥ 2, enhanced ESR and positive CRP) | ||||||||
| Outcomes reported: cumulative continuous remission rate | ||||||||
| Verma 2000,56 UK | Aim: to evaluate clinical effectiveness of adding elemental nutrition taken orally to normal food for maintaining remission in patients with quiescent CD over 12 months | Inclusion criteria: patients with quiescent disease defined by the absence of bowel symptoms and CDAI score of < 150 points who had been treated with either elemental nutrition or prednisolone as an induction therapy within preceding 12 months | Elemental nutrition: elemental nutrition EO28 Extra (Nutricia Ltd, Trowbridge, UK) powder taken orally in three separate portions daily (with normal unrestricted diet) | Patients assigned (n) | 21 | 18 | NA | |
| Study setting: specialty clinic | Exclusion criteria: CDAI score of > 150 points, sepsis, bowel strictures leading to recurrent attacks of small bowel obstruction or previous intolerance to enteral feeding | Control 1: no intervention (i.e. normal unrestricted diet) | Patients analysed (n) | 17 | 18 | NA | ||
| Length of follow-up (months): 24 | Control 2: NA | Age (years), mean (SD) | 39.2 (3.9) | 42.0 (3.3) | NA | |||
| Funding: NR | Gender (female), n/N (%) | 14/21 (66.6) | 13/18 (72.2) | NA | ||||
| Weight (kg), mean (SD) | 59.4 (2.9) | 62.7 (2.8) | NA | |||||
| BMI (kg/m2), mean (SD) | 20.0 (2.2) | 22.9 (0.9) | NA | |||||
| Smoking, n/N (%) | NR | NR | NA | |||||
| Duration of CD (months), mean (SD) | 60.3 (18.4) | 91.0 (14.8) | NA | |||||
| CDAI score (points), mean (SD) | 112.8 (11.5) | 94.6 (7.1) | NA | |||||
| Location of CD, n/N (%) | ||||||||
| Small bowel | 10/17 (58.8) | 7/18 (38.8) | NA | |||||
| Large bowel | 5/17 (29.4) | 5/18 (27.7) | ||||||
| Mixed bowel | 6/17 (35.3) | 3/18 (16.6) | ||||||
| Anastomotic | 0/17 (0.0) | 3/18 (16.6) | ||||||
| Previous bowel resection, n/N (%) | NR | NR | NA | |||||
| Type of induction therapy: medical (prednisolone, azathioprine, 5-ASA) | ||||||||
| Total number who received induction therapy: 46 | ||||||||
| Total number who achieved remission after induction therapy: 39 | ||||||||
| Total number allocated to maintenance treatment: 39 | ||||||||
| Diagnostic criteria used for CD: standard clinical, endoscopic, radiological, and when possible, histological criteria | ||||||||
| Co-interventions: prednisolone (mean range: 10.5–17.5 mg/day) azathioprine (dose: NR) | ||||||||
| 5-ASA (dose: NR) | ||||||||
| Outcome definitions applied: remission CDAI score of < 150 points, relapse/recurrence increase in CDAI score by >100 points since baseline or final CDAI score of > 150 points; need of surgery; increased doses of steroids | ||||||||
| Outcomes reported: maintenance of clinical remission at 12 months, withdrawal from steroids, and duration of remission at 24 months | ||||||||
| Yamamoto 2010,58 Japan | Aim: to assess the efficacy of elemental nutrition on the maintenance rate of clinical remission in patients with quiescent CD receiving infliximab as maintenance therapy | Inclusion criteria: patients diagnosed with CD who had achieved clinical remission (CDAI score of < 150 points after infliximab induction therapy) with time from the induction of remission to entry ≤ 2 weeks; patients who had received enteral nutrition including elemental nutrition infusion at least one time before entry; and patients who agreed to continue with the assigned treatment (with or without concomitant enteral nutrition) for 56 weeks | Elemental nutrition: elemental nutrition via nasogastric tube infusion during night-time [Elental, (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan)] + drug (infliximab 5 mg/kg) (with restricted low-fat diet) | Patients assigned (n) | 32 | 24 | NA | |
| Study setting: specialty clinic | Exclusion criteria: patients who had severe anorectal involvement; patients who had tight bowel strictures or enteric fistulae even if clinical symptoms were quiescent | Control 1: drug (Infliximab 5 mg/kg) (with unrestricted low-fat diet) | Patients analysed (n) | 32 | 24 | NA | ||
| Length of follow-up (months): 14 | Control 2: NA | Age (years), mean (SD) | 31.0 (9.0) | 33.0 (7.8) | NA | |||
| Funding: NR | Gender (female), n/N (%) | 12/32 (37.5) | 8/24 (33.3) | NA | ||||
| Weight (kg), mean (SD) | NR | NR | NA | |||||
| BMI (kg/m2), mean (SD) | NR | NR | NA | |||||
| Smoking, n/N (%) | 4/32 (12.5) | 4/24 (16.6) | NA | |||||
| Duration of CD (months), mean (SD) | 33.0 (24.8) | 35.0 (19.6) | NA | |||||
| CDAI score (points), mean (SD) | 102.1 (18.1) | 102.3 (22.5) | NA | |||||
| Location of CD, n/N (%) | ||||||||
| Small bowel | 11/32 (34.4) | 11/24 (45.8) | NA | |||||
| Small bowel and colon | 21/32 (65.6) | 13/24 (54.1) | ||||||
| Previous bowel resection, n/N (%) | 11/32 (34.4) | 8/24 (33.3) | NA | |||||
| Type of induction therapy: medical (infliximab 5 mg/kg) | ||||||||
| Total number who received induction therapy: NR | ||||||||
| Total number who achieved remission after induction therapy: 56 | ||||||||
| Total number allocated to maintenance treatment: 56 | ||||||||
| Diagnostic criteria used for CD: NR | ||||||||
| Co-interventions: mesalazine (Pentasa®, Ferring) (3 g/day), azathioprine (Imuran®, Aspen) (50–100 mg/day) | ||||||||
| Outcome definitions applied: remission CDAI score of < 150 points, relapse/recurrence score CDAI score of > 150 points | ||||||||
| Outcomes reported: remission maintenance rate, time to relapse | ||||||||
| Yamamoto,28,59,60 Japan | Aim: to examine if long-term elemental nutrition infusion along with low-fat diet is useful in reducing clinical and endoscopic recurrence rates after resection for CD | Inclusion criteria: patients with endoscopic and histological diagnosis of CD, aged 15–75 years who had resection for ileal and ileocolonic (including ileocaecal) CD; patients who had received enteral nutrition including elemental nutrition infusion at least once before operation; agreed to continue assigned treatment (with or without enteral nutrition) for more than 1 year after operation | Elemental nutrition: Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) infused at home nasogastrically via self-intubated tube in the night-time 1 week after operation (with restricted food diet) | Patients assigned (n) | 20 | 20 | NA | |
| Study setting: specialty clinic | Exclusion criteria: patients with colonic CD alone or with diffuse small bowel CD | Control 1: no intervention (i.e. normal unrestricted diet) | Patients analysed (n) | 20 | 20 | NA | ||
| Length of follow-up (months): 12 | Control 2: NA | Age (years), mean (SD) | 31.0 (16.5) | 33.0 (17.4) | NA | |||
| Funding: no external funding received | Gender (female), n/N (%) | 8/20 (40.0) | 6/20 (30.0) | NA | ||||
| Weight (kg), mean (SD) | NR | NR | NA | |||||
| BMI (kg/m2), mean (SD) | NR | NR | NA | |||||
| Smoking, n/N (%) | 2/20 (10.0) | 2/20 (10.0) | NA | |||||
| Duration of CD (months); mean (SD) | 37.0 (31.7) | 39.0 (36.7) | NA | |||||
| CDAI score (points); mean (SD) | NR | NR | NA | |||||
| Location of CD, n/N (%) | ||||||||
| Terminal ileum | 5/20 (25.0) | 7/20 (35.0) | NA | |||||
| Terminal ileum and colon | 11/20 (55.0) | 9/20 (45.0) | NA | |||||
| Ileocolonic anastomosis | 4/20 (20.0) | 4/20 (20.0) | NA | |||||
| Previous bowel resection, n/N (%) | 20/20 (100.0) | 20/20 (100.0) | NA | |||||
| Type of induction therapy [n (%)]: bowel resection [40/40 (100.0)], corticosteroids [37/40 (92.5)], Pentasa [32/40 (77.5)] | ||||||||
| Total number who received induction therapy: NR | ||||||||
| Total number who achieved remission after induction therapy: NR | ||||||||
| Total number allocated to maintenance treatment: 40 | ||||||||
| Diagnostic criteria used for CD: endoscopic and histological (no specific criteria reported) | ||||||||
| Co-interventions: Pentasa 3000 mg/day as a prophylactic medication | ||||||||
| No corticosteroid, immunosuppressive drugs or infliximab except patients who relapsed | ||||||||
| Outcome definitions applied: remission CDAI score of < 150 points (clinical), Rutgeerts score < 2 (endoscopic), relapse/recurrence clinical (at 6 and 12 months: CDAI score of ≥ 150 points; at 60 months: CDAI score of ≥ 200 points), endoscopic (Rutgeerts score ≥ 2) | ||||||||
| Outcomes reported: clinical and endoscopic recurrence | ||||||||
| Yamamoto 2007,57 Japan | Aim: to investigate if long-term enteral nutrition (vs. no intervention) is effective in reducing clinical and endoscopic relapse rates and inhibiting mucosal cytokine production in patients with quiescent CD | Inclusion criteria: patient with endoscopic/histological diagnosis of CD in the terminal ileum and/or the colon; age: 15–75 years; clinical remission (CDAI score of <150 points) after medical treatment; the duration from the induction of remission to entry < 8 weeks; patients had experienced enteral nutrition therapy including elemental nutrition infusion at least one time before entry; patient agreed to continue with assigned treatment (with or without enteral nutrition) for > 1 year; and patient agreed to have ileocolonoscopy with multiple mucosal biopsies even if they did not have any clinical symptoms | Elemental nutrition: Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) (with restricted food diet) | Patients assigned (n) | 20 | 20 | NA | |
| Study setting: NR | Exclusion criteria: diffuse jejunoileal or gastroduodenal; severe anorectal stricture or sepsis; tight bowel strictures or enteric fistulae even though clinical symptoms were quiescent; patient had received corticosteroids, immunosuppressive drugs or infliximab at entry | Control 1: no intervention (i.e. normal unrestricted diet) | Patients analysed (n) | 20 | 20 | NA | ||
| Length of follow-up number of months): 12 | Control 2: NA | Age (years), mean (SD) | 29.0 (17.4) | 31.0 (20.1) | NA | |||
| Funding: NR | Gender (female), n/N (%) | 6/20 (30.0) | 7/20 (35.0) | NA | ||||
| Weight (kg), mean (SD) | 51.1 (8.5) | 48.9 (7.6) | NA | |||||
| BMI (kg/m2), mean (SD) | 19.2 (1.3) | 19.1 (1.8) | NA | |||||
| Smoking, n/N (%) | 2/20 (10.0) | 4/20 (20.0) | NA | |||||
| Duration of CD (months), mean (SD) | 32.0 (35.3) | 36.0 (38.9) | NA | |||||
| CDAI score (points), mean (SD) | 101.0 (28.2) | 92.0 (21.5) | NA | |||||
| Location of CD, n/N (%) | ||||||||
| Terminal ileum | 7/20 (35.0) | 8/20 (40.0) | NA | |||||
| Colon | 2/20 (10.0) | 2/20 (10.0) | NA | |||||
| Terminal ileum and colon | 11/20 (55.0) | 10/20 (50.0) | NA | |||||
| Previous bowel resection, n/N (%) | 4/20 (20.0) | 4/20 (20.0) | NA | |||||
| Type of induction therapy [n (%)]: four patients (5 mg/kg × 1 or × 3 prednisolone, infliximab), six patients (prednisolone with enteral nutrition), 10 patients (prednisolone alone), 20 patients (enteral nutrition alone), 36 patients (Pentasa 750–3000 mg/day), and the majority of patients required parenteral nutrition at the start of the treatment | ||||||||
| Total number who received induction therapy: NR | ||||||||
| Total number who achieved remission after induction therapy: NR | ||||||||
| Total number allocated to maintenance treatment: 40 | ||||||||
| Diagnostic criteria used for CD: endoscopic and histological (not specified) | ||||||||
| Co-interventions: Pentasa 3000 mg/day as a prophylactic medication. No corticosteroid, immunosuppressive drugs or infliximab except patients who relapsed | ||||||||
| Outcome definitions applied: remission CDAI score of < 150 points (clinical), NR (endoscopic; specific threshold for the mucosal inflammation grade NR), relapse/recurrence CDAI score of ≥ 150 points (clinical), NR (endoscopic; specific threshold for the mucosal inflammation grade NR) | ||||||||
| Outcomes reported: CDAI score, cumulative proportion of patients maintaining clinical remission (CDAI score of < 150 points), endoscopic severity of disease activity/mucosal inflammation, mucosal cytokine assays | ||||||||
In all five trials, the elemental nutrition was given in addition to either restricted28,51,57,58 or unrestricted diet (i.e. normal/free diet)56 through feeding tube infusion28,51,57,58 or oral intake. 56 Participants in the elemental nutrition groups were asked to take half of the daily calories through elemental nutrition. 28,57,58 The elemental nutrition groups received either elemental nutrition alone28,51,56,57 or elemental nutrition with drug (sulfasalazine/prednisolone51 or infliximab58). Participants in the control groups were assigned to receive unrestricted/restricted diet (no intervention),28,51,56,57 drug only (sulfasalazine/prednisolone51 or infliximab58).
Remission was defined clinically using CDAI score of < 150 points alone28,56–58 or with additional clinical/endoscopic criteria such as normal values of International Organisation for the Study of Inflammatory Bowel Disease (IOIBD), ESR and CRP scores51 or Rutgeerts score < 2. 28,57 Relapse/recurrence was defined by subjective/objective symptoms (increase of the IOIBD score by ≥ 2, enhanced ESR/CRP,51 increase in CDAI score by > 100 points after baseline, final CDAI score of > 150 points, need of surgery, or increased doses of steroids,56 or CDAI scores of ≥ 150 points). 28,57,58
Risk of bias assessment
Risk of bias assessment for the eight included studies (three RCTs50,52,55 and five nRCTs28,51,56–58) are presented in RoB tables and graphs separately for RCTs (Table 3 and Figure 2) and nRCTs (Table 4 and Figure 3).
| Study | Selection bias, random sequence generation | Selection bias, allocation concealment | Performance bias, subjective (e.g. patient reported) | Performance bias, objective (e.g. radiography, endoscopy) | Detection bias, subjective (e.g. patient reported) | Detection bias, objective (e.g. radiography, endoscopy) | Attrition bias, subjective (e.g. patient reported) | Attrition bias, objective (e.g. radiography, endoscopy) | Reporting bias, selective reporting of the outcome, subgroups or analysis | Other bias, funding source, adequacy of statistical methods used, type of analysis (ITT/PP), baseline imbalance in important characteristics |
|---|---|---|---|---|---|---|---|---|---|---|
| Hanai 201250 | + | ? | – | + | – | + | + | + | – | + |
| Takagi 200652,53 200954 | + | + | – | + | – | + | + | + | – | + |
| Verma 200155 | ? | ? | – | + | – | + | + | + | – | ? |
FIGURE 2.
Overall RoB assessment: RCTs. ITT, intention to treat; NA, not applicable; PP, per protocol.

| Study | Selection bias, the presence/absence of baseline between-group imbalance in important prognostic factors (e.g. age, gender, CDAI score, duration of CD, location of CD, complications during induction therapy, type of induction therapy, pre-study compliance, co-intervention, and/or smoking) | Performance bias, subjective (e.g. patient reported) | Performance bias, objective (e.g. radiography, endoscopy) | Detection bias, subjective (e.g. patient reported) | Detection bias, objective (e.g. radiography, endoscopy) | Attrition bias, subjective (e.g. patient reported) | Attrition bias, objective (e.g. radiography, endoscopy) | Reporting bias, selective reporting of the outcome, subgroups or analysis | Other bias, funding source, adequacy of statistical methods used, type of analysis (ITT/PP) |
|---|---|---|---|---|---|---|---|---|---|
| Hirakawa 199351 | – | NA | + | NA | + | NA | – | – | – |
| Verma 200056 | – | – | + | – | + | + | + | – | + |
| Yamamoto 200728,60 | ? | – | + | – | + | + | + | + | + |
| Yamamoto 200757 | ? | – | + | – | + | + | + | + | + |
| Yamamoto 201058 | ? | – | + | – | + | + | + | + | + |
FIGURE 3.
Overall RoB assessment: nRCTs. ITT, intention to treat; NA, not applicable; PP, per protocol.

Randomised controlled trials
Overall, two50,52 of the three RCTs reported an adequate method for random sequence generation and only one52 reported adequate treatment allocation concealment (low RoB). All three RCTs were rated as having low risk of performance and detection bias for objective (e.g. radiography, endoscopy) compared with subjective (e.g. patient-administered functional scores, CDAI scores) outcomes. The RCTs failed to report blinding status of the patients and study personnel. But, based on the nature of the administered intervention, it is unlikely that study personnel and participants in these studies were blinded. In two RCTs,50,55 it was not clear if outcome assessors were blinded. Outcome assessors in one RCT52 were reported to be blinded. For the three RCTs, the influence of attrition bias was judged at low risk and all three RCTs were judged as being at high risk for selective outcome and/or analysis bias. Risk of other bias (e.g. funding source, balance imbalance in important characteristics, inappropriate analysis) for two RCTs50,52 was judged to be low.
Non-randomised controlled trials
The presence of imbalance in important baseline factors was suspected for two nRCTs (high RoB)51,56 and was unclear for the remaining three nRCTs. 28,57,58 In the first trial,51 there was some between-group imbalance in induction therapy and distribution of the lesion. In the second trial,56 the elemental nutrition group had a shorter disease duration (60.3 vs. 91.0 months), greater ESR and a longer steroid use than the no intervention group. Four nRCTs28,56–58 were rated as having low risk of performance and detection bias for objective (e.g. radiography, endoscopy) compared with subjective (e.g. patient-administered functional scores, CDAI scores) outcomes. Three RCTs51,56,58 failed to report blinding status of the patients, study personnel, as well as outcome assessors. Based on the nature of the administered intervention in these studies, it is unlikely that study personnel and participants were blinded. The remaining two nRCTs28,57 explicitly reported that patients and study personnel were not blinded, but outcome assessors were blinded. For four nRCTs,28,56–58 the influence of attrition bias was judged at low risk. Three of the five nRCTs28,57,58 were judged as being at low risk for selective outcome and/or analysis bias. Risk of other bias (e.g. funding source, balance imbalance in important characteristics, inappropriate analysis) for four nRCTs28,56–58 was judged to be low.
Clinical effectiveness of elemental nutrition
The results of included trials are provided in Tables 5–23. Partial results (e.g. missing effect measures, 95% CIs) or statistically non-significant effect measures with wide 95% CIs were considered inconclusive.
Maintenance of remission
In seven of the eight included trials, the maintenance of remission was reported as the proportion of patients maintaining remission28,50,55–58 and/or the cumulative probability of maintaining remission (Kaplan–Meier estimates of survival). 50,51,57,58 This outcome was not reported for one trial. 52 None of the trials reported duration of remission, see Tables 5–8.
Elemental nutrition compared with no intervention (i.e. unrestricted/free or restricted diet)
Randomised controlled trials
In one trial,50 the maintenance of remission at 6 and 12 months post treatment did not differ statistically significantly between the elemental nutrition and no intervention groups (review conclusion: inconclusive). However, at 24 months of follow-up, elemental nutrition was significantly more beneficial in maintaining remission than no intervention (RR 2.06, 95% CI 1.00 to 4.43). The same trial reported a statistically significantly greater cumulative probability of being in remission for the participants who received elemental nutrition versus no intervention at 18 (p = 0.04) and 24 months of follow-up (p = 0.03) (review conclusion: inconclusive) (Tables 5 and 6).
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of RCTs (SRoB across studies)b | Treatment effect conclusionc |
|---|---|---|---|---|
| Elemental nutrition (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | NR52 | NR | 1 (NA) | No evidence |
| Elemental nutrition (with restricted diet) vs. 6-MP (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| Elemental nutrition vs. 6-MP | Elemental nutrition vs. 6-MP | |||
| 6 | 27/32 (84.4) vs. 24/30 (80.0)50 | RR 1.05 (0.83 to 1.33)d | 1 (high RoB) | Inconclusive (elemental nutrition vs. 6-MP) |
| 12 | 20/32 (62.5) vs. 20/30 (66.7)50 | RR 0.93 (0.64 to 1.35)d | Inconclusive (elemental nutrition vs. NI at 6–12 months) | |
| 24 | 14/32 (46.9) vs. 17/30 (56.7)50 | RR 0.77 (0.46 to 1.27)d | In favour of elemental nutrition (vs. NI) at 24 months | |
| Elemental nutrition vs. NI | Elemental nutrition vs. NI | |||
| 6 | 27/32 (84.4) vs. 23/33 (69.6)50 | RR 1.21 (0.92 to 1.58)d | ||
| 12 | 20/32 (62.5) vs. 15/33 (45.5)50 | RR 1.37 (0.86 to 2.17)d | ||
| 24 | 14/32 (46.9) vs. 7/33 (21.2)50 | RR 2.06 (1.00 to 4.43)d | ||
| Elemental nutrition (with unrestricted diet) vs. polymeric nutrition (with unrestricted diet) | ||||
| 12 | 8/19 (42.1) vs. 6/14 (42.8)55 (remission: CDAI plus other criteria) | p = NR (NS), RR 0.98 (0.44 to 2.19)d | 1 (unclear RoB) | Inconclusive |
| Follow-up (months) | Arm-specific Kaplan–Meier survival rate estimates | Difference (p-value or 95% CI) | Number of RCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | NR52 | NR | 1 (NA) | No evidence |
| Elemental nutrition (with restricted diet) vs. 6-MP (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| Elemental nutrition vs. 6-MP | Elemental nutrition vs. 6-MP | |||
| 6 | NR50 | p = 0.83 (NS) | 1 (high RoB) | Inconclusive |
| 12 | NR50 | p = 0.54 (NS) | ||
| 18 | NR50 | p = 0.41 (NS) | ||
| 24 | NR50 | p = 0.31 (NS) | ||
| Elemental nutrition vs. NI | Elemental nutrition vs. NI | |||
| 6 | NR50 | p = 0.19 (NS) | ||
| 12 | NR50 | p = 0.17 (NS) | ||
| 18 | NR50 | p = 0.04 (SS) | ||
| 24 | NR50 | p = 0.03 (SS) | ||
| Elemental nutrition (with unrestricted diet) vs. polymeric nutrition (with unrestricted diet) | ||||
| 12 | NR55 | NR | 1 (NA) | Inconclusive |
Non-randomised controlled trials
Two of the three trials,28,56,57 reporting maintenance of remission (i.e. proportion of patients maintaining remission), indicated significantly greater rates of maintenance in favour of elemental nutrition at 12 months post baseline. 28,57 For example, in one of these trials,57 significantly more participants receiving elemental nutrition maintained their remission at 12 months of follow-up (RR 2.14, 95% CI 1.12 to 4.10). The results regarding maintenance of remission reported in one trial56 and cumulative probability of maintaining remission at 48 months reported in one trial (no intervention: restricted diet)51 were rendered inconclusive owing to wide statistically non-significant 95% CIs56 and partially reported data (missing effect estimates and 95% CIs), respectively,51 Tables 7 and 8.
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of nRCTs (SRoB across studies)b | Treatment effect conclusionc |
|---|---|---|---|---|
| Elemental nutrition (unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 10/21 (47.6) vs. 4/18 (22.2)56 | p = 0.0003 (SS), RR 2.14 (0.81 to 5.67); p = 0.18 (NS)d | 1 (high RoB) | Inconclusive |
| Elemental nutrition (restricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 19/20 (95.0) vs. 13/20 (65.0)30 | p = NR, RR 1.46 (1.04 to 2.05)d | 2 (high RoB) | In favour of elemental nutrition |
| 12 | 15/20 (75.0) vs. 7/20 (35.0)57 | p = 0.01 (SS), RR 2.14 (1.12 to 4.10)d | ||
| Elemental nutrition (restricted diet) vs. elemental nutrition/druge (restricted diet) vs. druge (restricted diet) vs. NI (restricted diet) | ||||
| 12, 24, 48 | NR51 | NR | 1 (NA) | No evidence |
| Elemental nutrition/drugf (restricted diet) vs. drugf (unrestricted diet) | ||||
| 14 | 25/32 (78.1) vs. 16/24 (66.6)58 | p = 0.51 (NS), RR 1.17 (0.83 to 1.64)d | 1 (high RoB) | Inconclusive |
| Follow-up (months) | Arm-specific Kaplan–Meier survival rate estimates | Difference (p-value or 95% CI) | Number of nRCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | NR56 | NR | 1 (NA) | No evidence |
| Elemental nutrition (restricted diet) vs. NI (unrestricted diet) | ||||
| 6, 12, 60 | NR30 | NR | 1 (NA) | No evidence |
| 12 | NR57 | p = 0.01 (SS) in favour of elemental nutrition as reported | 1 (high RoB) | Inconclusive |
| Elemental nutrition (restricted diet) vs. elemental nutrition/drugc (restricted diet) vs. drugc (restricted diet) vs. NI (restricted diet) | ||||
| At 48 months | ||||
| 12 | 94% (NR) vs. 75% (NR) vs. 63% (NR) vs. 50% (NR)51 | p < 0.05 (1 vs. 3) SS | 1 (high RoB) | Inconclusive |
| p < 0.01 (1 vs. 4) SS | ||||
| 24 | 63% (NR) vs. 66% (NR) vs. 42% (NR) vs. 33% (NR)51 | p < 0.05 (2 vs. 3) SS | ||
| p < 0.05 (2 vs. 4) SS | ||||
| 48 | 63% (NR) vs. 66% (NR) vs. 0% (NR) vs. 0% (NR)51 | p ≥ 0.05 (1 vs. 2) NS | ||
| Elemental nutrition/drugd (restricted diet) vs. drugd (unrestricted diet) | ||||
| 14 | NR58 | p = 0.32 (NS) | 1 (high RoB) | Inconclusive |
Elemental nutrition compared with drug
Randomised controlled trials
In one trial,50 the maintenance rate of remission (i.e. proportion of patients maintaining remission and cumulative probability of maintaining remission) at 6 to 24 months of follow-up was not significantly different between the participants receiving elemental nutrition and 6-MP. Owing to missing effect estimates (for the cumulative probability of maintaining remission) and wide 95% CIs (for the proportion of patients maintaining remission), this result was deemed inconclusive (see Tables 5 and 6).
Non-randomised controlled trials
One trial51 showed significantly greater cumulative probability of maintaining remission in participants receiving elemental nutrition compared with those on sulfasalazine/prednisolone at 48 months of follow-up (63% vs. 0%, p < 0.05). However, owing to partially reported data (i.e. missing 95% CIs), this result was deemed inconclusive, see Tables 7 and 8.
Elemental nutrition compared with elemental nutrition plus drug
Randomised controlled trials
No trial carried out these comparisons.
Non-randomised controlled trials
In one trial,51 the cumulative probability of maintaining remission was not significantly different for the participants receiving elemental nutrition compared with elemental nutrition plus sulfasalazine or prednisolone at 48 months of follow-up (63% vs. 66%, p > 0.05). Owing to partially reported data (i.e. missing 95% CIs), this result was deemed inconclusive (see Tables 7 and 8).
Elemental nutrition plus drug compared with drug
Randomised controlled trials
No trial carried out these comparisons.
Non-randomised controlled trials
In one trial,58 the proportion of patients maintaining remission (RR 1.17, 95% CI 0.83 to 1.64) and the cumulative probability of maintaining remission (p = 0.32) were not significantly different in the elemental nutrition plus infliximab group compared with infliximab alone group at 14 months of follow-up (review conclusion: inconclusive). In contrast, another trial51 showed a significant effect of adding elemental nutrition to sulfasalazine/prednisolone compared with sulfasalazine/prednisolone alone on the cumulative probability of maintaining remission at 48 months post baseline (66% vs. 0%, p < 0.05) (review conclusion: inconclusive) (see Tables 7 and 8).
Elemental nutrition compared with polymeric nutrition
Randomised controlled trials
In one trial,55 the proportion of participants maintaining remission was not significantly different between the groups receiving elemental and polymeric nutrition at 12 months of follow-up (RR 0.98, 95% CI 0.44 to 2.19) (review conclusion: inconclusive) (see Table 5).
Non-randomised controlled trials
No trial carried out these comparisons.
Development of relapse/recurrence
In seven of the eight included trials, the development of relapse/recurrence was reported as the proportion of patients developing relapse28,50,52,55–58 and/or mean time to relapse. 56 All seven studies reported clinical relapse (defined using CDAI alone or with other criteria) and one study28 additionally reported endoscopic relapse (Rutgeerts score ≥ 2) (Tables 9 and 10).
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of RCTs (SRoB across studies)b | Treatment effect conclusionc |
|---|---|---|---|---|
| Elemental nutrition (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 9/26 (34.6) vs. 16/25 (64.0)52 | HR 0.40 (0.16 to 0.98) adjusted estimate | 1 (low RoB) | In favour of elemental nutrition group |
| (Relapse: CDAI plus other criteria) | RR 0.54 (0.29 to 0.99)d | |||
| Elemental nutrition (with restricted diet) vs. 6-MP (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| Elemental nutrition vs. 6-MP | Elemental nutrition vs. 6-MP | |||
| 24 | 12/32 (37.5) vs. 7/30 (23.3)50 | RR 1.61 (0.73 to 3.53) day | 1 (low RoB) | Inconclusive (elemental nutrition vs. 6-MP) |
| (Relapse: CDAI plus other criteria) | ||||
| Elemental nutrition vs. NI | Elemental nutrition vs. NI | |||
| 24 | 12/32 (37.5) vs. 21/33 (63.6)50 | RR 0.58 (0.35 to 0.98) day | In favour of elemental nutrition group (vs. NI) | |
| (Relapse: CDAI plus other criteria) | ||||
| Elemental nutrition (with unrestricted diet) vs. polymeric nutrition (with unrestricted diet) | ||||
| 12 | 8/19 (42.1) vs. 5/14 (35.7)55 | p = NR (NS), RR 1.18 (0.48, 2.83)d | 1 (high RoB) | Inconclusive |
| Follow-up | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of nRCTs (SRoB across studies)b | Treatment effect conclusionc |
|---|---|---|---|---|
| Elemental nutrition (unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 months | 7/21 (33.3) vs. 14/18 (77.7)56 | p < 0.00001 (SS) | 1 (unclear RoB) | In favour of elemental nutrition |
| (Relapse: CDAI plus other criteria) | RR 0.50 (0.25 to 0.98)d | |||
| Elemental nutrition (restricted diet) vs. NI (unrestricted diet) | ||||
| Clinical relapse (CDAI score of ≥ 150/200 points) | Clinical relapse (12 months) | Clinical relapse | ||
| 12 months | 1/20 (5.0) vs. 7/20 (35.0)30 | p = 0.048 (SS) | 1 (high RoB) | In favour of elemental nutrition (at 12 months) |
| RR 0.14 (0.02 to 1.00)d | ||||
| Clinical relapse (60 months) | ||||
| 60 months | 6/20 (30.0) vs. 12/20 (60.0)30 | p = 0.11 (NS) | Inconclusive (at 60 months) | |
| RR 0.50 (0.23 to 1.07)d | ||||
| Endoscopic relapse (Rutgeerts score ≥ 2) | Endoscopic relapse (6 months) | Endoscopic relapse | ||
| 6 months | 5/20 (25.0) vs. 8/20 (40.0)30 | p = 0.50 (NS) | 1 (low RoB) | Inconclusive (at 6 months) |
| RR 0.62 (0.24 to 1.58)d | ||||
| Endoscopic relapse (12 months) | ||||
| 12 months | 6/20 (30.0) vs. 14/20 (70.0)30 | p = 0.027 (SS) | In favour of elemental nutrition (12 months) | |
| RR 0.42 (0.20 to 0.88)d | ||||
| Endoscopic relapse (60 months) | ||||
| 60 months | 9/16 (56.2) vs. 14/17 (82.3)30 | p = 0.21 (NS) | Inconclusive (at 60 months) | |
| RR 0.68 (0.42 to 1.11)d | ||||
| 12 months | 5/20 (25.0) vs. 13/20 (65.0)57 | OR 0.20 (0.04 to 0.70), p = 0.03d | 1 (high RoB) | In favour of elemental nutrition |
| RR 0.38 (0.16 to 0.87)d | ||||
| Elemental nutrition (restricted diet) vs. elemental nutrition/druge (restricted diet) vs. druge (restricted diet) vs. NI (restricted diet) | ||||
| 12, 24, 48 months | NR51 | NR | 1 (NA) | Inconclusive |
| Elemental nutrition/drugf (restricted diet) vs. drugf (unrestricted diet) | ||||
| 14 months | 7/32 (21.8) vs. 8/24 (33.3)58 | p = 0.51 (NS) | 1 (high RoB) | Inconclusive |
| RR 0.65 (0.27 to 1.56)d | ||||
Elemental nutrition compared with no intervention (i.e. unrestricted/free diet)
Randomised controlled trials
Our meta-analysis of two RCTs50,52 indicated a significantly reduced risk of relapse among participants receiving elemental nutrition compared with no intervention at 12–24 months of follow-up (pooled RR 0.57, 95% CI 0.38 to 0.84; χ2 = 0.04; p = 0.83; I2 = 0%) (Figure 4 and see Table 9).
FIGURE 4.
Patients developing relapse/recurrence at 12 to 24 months: elemental nutrition compared with no intervention (unrestricted diet). df, degrees of freedom, M–H, Mantel–Haenszel.
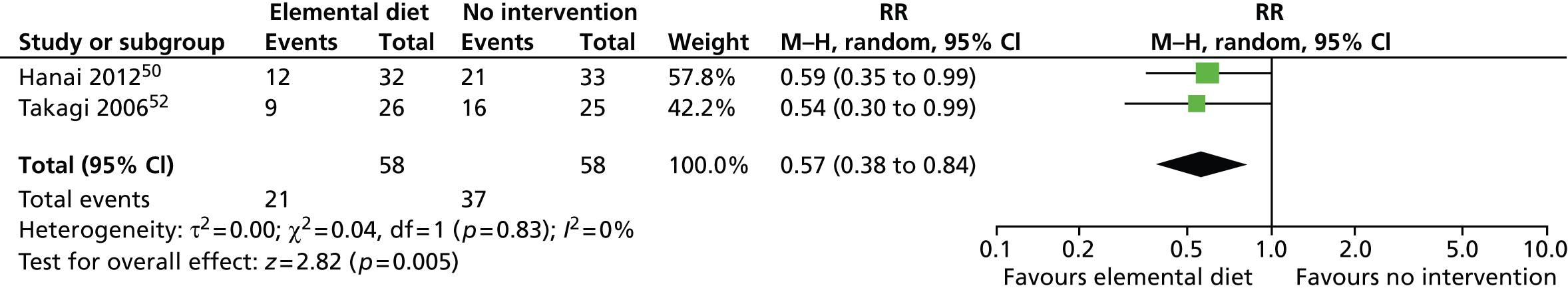
Non-randomised controlled trials
Findings from three trials consistently showed a significant benefit of elemental nutrition compared with no intervention in reducing risk of clinical (RR 0.50, 95% CI 0.25 to 0.98;56 RR 0.14, 95% CI 0.02 to 1.00;28 and RR 0.38, 95% CI 0.16 to 0.8757) as well as endoscopic relapse (RR 0.42, 95% CI 0.20 to 0.88)28 at 12 months post baseline. In one of the trials,28 the between-group difference in the risk of endoscopic relapse at 60-month follow-up was not statistically significant (RR 0.68, 95% CI 0.42 to 1.11) (review conclusion: inconclusive) (see Table 10).
In one trial,56 at 12 months post baseline, the mean time (in months) to relapse in the elemental nutrition group was significantly longer than in the no intervention group (7.4 vs. 6.2, MD: 1.20, 95% CI 0.35 to 2.04) (Table 11).
| Follow-up (months) | Arm-specific estimates, mean (SD or 95% CI) | Difference (p-value or 95% CI) | Number of nRCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 7.4 (0.9) vs. 6.2 (0.4)56 | p = NR, MD = 1.20 (0.35 to 2.04); p = 0.012c | 1 (unclear RoB) | In favour of elemental nutrition |
| Elemental nutrition (restricted diet) vs. NI (unrestricted diet) | ||||
| 6, 12, 60 | NR28 | NR | 1 (NA) | No evidence |
| 12 | NR57 | NR | 1 (NA) | No evidence |
| Elemental nutrition (restricted diet) vs. elemental nutrition/drugd (restricted diet) vs. drugd (restricted diet) vs. NI (restricted diet) | ||||
| 12, 24, 48 | NR51 | NR | 1 (NA) | No evidence |
| Elemental nutrition/druge (restricted diet) vs. druge (unrestricted diet) | ||||
| 14 | NR58 | NR | 1 (NA) | No evidence |
Elemental nutrition compared with drug
Elemental nutrition compared with elemental nutrition plus drug
Randomised controlled trials
No trial with these comparisons.
Elemental nutrition plus drug compared with drug
Randomised controlled trials
No trial carried out these comparisons.
Non-randomised controlled trials
Of the two available trials with the above-mentioned comparisons,51,58 only one reported this outcome. 58 In this trial, the difference in the occurrence of relapse between participants receiving elemental nutrition plus infliximab compared with infliximab alone was not statistically significant (RR 0.65, 95% CI 0.27 to 1.56) (review conclusion: inconclusive) (see Table 10).
Elemental nutrition compared with polymeric nutrition
Randomised controlled trials
In one trial,55 at 12 months of follow-up, the difference in the occurrence of relapse between participants receiving elemental and polymeric nutrition was not statistically significant (RR 1.18, 95% CI 0.48 to 2.83) (review conclusion: inconclusive) (see Table 9).
Non-randomised controlled trials
No trial carried out these comparisons.
Incidence of mucosal healing (endoscopic remission)
Only one of the eight28,50–52,55–58 included trials (non-randomised study)57 reported this outcome, which was based on mucosal inflammation grade categorised as follows: 0 = macroscopically normal, 1 = granular mucosa and contact bleeding, 2 = erythematous and oedematous mucosa, aphthoid or superficial ulcers, and 3 = deep ulcers with slough and inflammatory pseudopolyps. In this non-randomised study, at 12 months of follow-up, the proportion of participants achieving grade 0 between elemental nutrition and no intervention (unrestricted diet) groups was not significantly different (RR 2.70, 95% CI 0.62 to 11.72) (review conclusion: inconclusive) (Table 12).
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of nRCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | NR56 | NR | 1 (NA) | No evidence |
| Elemental nutrition (restricted diet) vs. NI (unrestricted diet) | ||||
| 6, 12, 60 | NR28 | NR | 1 (NA) | No evidence |
| 12 | 6/20 (30.0) vs. 2/18 (11.1).57 (grade 0: macroscopically normal) | p = NR, RR 2.70 (0.62 to 11.72)c | 1 (low RoB) | Inconclusive |
| Elemental nutrition (restricted diet) vs. elemental nutrition/drugd (restricted diet) vs. drugd (restricted diet) vs. NI (restricted diet) | ||||
| 12, 24, 48 | NR51 | NR | 1 (NA) | No evidence |
| Elemental nutrition/druge (restricted diet) vs. druge (unrestricted diet) | ||||
| 14 | NR58 | NR | 1 (NA) | No evidence |
Need for surgery
Three of the eight28,50–52,55–58 included trials reported this outcome: one RCT50 and two nRCTs. 28,57 See Tables 13 and 14.
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of RCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | NR52 | NR | 1 (NA) | No evidence |
| Elemental nutrition (with restricted diet) vs. 6-MP (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| Elemental nutrition vs. 6-MP | Elemental nutrition vs. 6-MP | |||
| 24 | 1/32 (3.1) vs. 1/30 (3.1)50 | p > 0.99 (NS), Fisher’s exact test,c RR 0.93 (0.06 to 14.32)c | 1 (low RoB) | Inconclusive |
| Elemental nutrition vs. NI | Elemental nutrition vs. NI | |||
| 24 | 1/32 (3.1) vs. 1/33 (3.0)50 | p > 0.99 (NS), Fisher’s exact test,c RR 1.03 (0.06 to 15.79)c | ||
| Elemental nutrition (with unrestricted diet) vs. polymeric nutrition (with unrestricted diet) | ||||
| 12 | NR55 | NR | 1 (NA) | No evidence |
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of nRCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | NR56 | NR | 1 (NA) | Inconclusive |
| Elemental nutrition (restricted diet) vs. NI (unrestricted diet) | ||||
| 60 | 1/20 (5.0) vs. 5/20 (25.0)28 | p = 0.18 (NS), RR 0.20 (0.02 to 1.56)c | 2 (low RoB) | Inconclusive |
| 12 | 0/20 (0.0) vs. 2/20 (10.0)57 | p = NR | ||
| Elemental nutrition (restricted diet) vs. elemental nutrition/drugd (restricted diet) vs. drugd (restricted diet) vs. NI (restricted diet) | ||||
| 12, 24, 48 | NR51 | NR | 1 (NA) | Inconclusive |
| Elemental nutrition/druge (restricted diet) vs. druge (unrestricted diet) | ||||
| 14 | NR58 | NR | 1 (NA) | No evidence |
Elemental nutrition compared with no intervention (i.e. unrestricted/free diet)
Randomised controlled trials
At the 24-month follow-up,50 the proportion of participants in need of surgery was not statistically significantly different between the elemental nutrition and no intervention groups (RR 1.03, 95% CI 0.06 to 15.79; Fisher’s exact test, p > 0.99) (review conclusion: inconclusive) (see Table 13).
Non-randomised controlled trials
In two trials,28,57 at 12–60 months of follow-up, the difference in proportion of participants in need of surgery between the elemental nutrition and no intervention groups was not statistically significant (RR 0.20, 95% CI 0.02 to 1.56) (review conclusion: inconclusive) (Table 14).
Elemental nutrition compared with drug
Randomised controlled trials
At the 24-month follow-up,50 the difference in proportion of participants in need of surgery between the elemental nutrition and 6-MP groups was not statistically significant (RR 0.93, 95% CI 0.06 to 14.32; Fisher’s exact test p > 0.99) (review conclusion: inconclusive), see Table 13.
Adherence
Seven of the eight30,50–52,55–58 included trials reported any information on adherence: two RCTs52,55 and five nRCTs,28,51,56–58 Tables 15 and 16.
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of RCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 20/26 (77.0) vs. 20/25 (80.0)52 | RR 0.96 (0.720 to 1.28)c | 1 (low RoB) | Inconclusive |
| Elemental nutrition (with restricted diet) vs. 6-MP (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 24 | NR50 | NR | 1 (NA) | No evidence |
| Elemental nutrition (with unrestricted diet) vs. polymeric nutrition (with unrestricted diet) | ||||
| 12 | 13/19 (68.4) vs. 14/14 (100.0)55 | RR 0.68 (0.50 to 0.92)c | 1 (unclear RoB) | In favour of polymeric nutrition group |
| Follow-up | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of nRCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 17/21 (80.9) vs. 18/18 (100.0)56 | p = NR, RR 0.81 (0.65 to 0.99)c | 1 (unclear RoB) | In favour of NI group |
| Elemental nutrition (restricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 20/20 (100.0) vs. 20/20 (100.0)28 | p = NR | 2 (low RoB) | In favour of the NI (60 months) |
| 60 | 16/20 (80.0) vs. 20/20 (100.0)28 | RR 0.80 (0.64 to 0.99)c | ||
| 12 | 18/20 (90.0) vs. 20/20 (100.0)57 | p = 0.48 Fisher’s exact testc NS | Inconclusive | |
| Elemental nutrition (restricted diet) vs. elemental nutrition/drugd (restricted diet) vs. drugd (restricted diet) vs. NI (restricted diet) | ||||
| 48 | 22/25 (88.0) vs. 17/22 (77.3) vs. 8/8 (100.0) vs. 6/6 (100.0)51 | Fisher’s exact testc | 1 (low RoB) | Inconclusive |
| p = 0.55 (1 vs. 2), NS | ||||
| p = 0.84 (1 vs. 3), NS | ||||
| p > 0.99 (1 vs. 4), NS | ||||
| p = 0.37 (2 vs. 3), NS | ||||
| p = 0.53 (2 vs. 4), NS | ||||
| Elemental nutrition/druge (restricted diet) vs. druge (unrestricted diet) | ||||
| 14 | 25/32 (78.1) vs. NR (NR)58 | NR | 1 (NA) | No evidence |
Elemental nutrition versus no intervention (i.e. unrestricted/free or restricted diet)
Randomised controlled trials
In one RCT,52 the difference in the rates of adherence at 12 months of follow-up between the groups of elemental nutrition and no intervention (unrestricted diet) was not statistically significant (77% vs. 80%; RR 0.96, 95% CI 0.72 to 1.28) (review conclusion: inconclusive) (see Table 15).
Non-randomised controlled trials
The rate of adherence reported for two trials28,56 was significantly lower in the elemental nutrition than in the no intervention group at 12 months (RR 0.81, 95% CI 0.65 to 0.99)56 and at 60 months (RR 0.80, 95% CI 0.64 to 0.99)28 after the baseline. For the remaining two trials comparing elemental nutrition with no intervention (unrestricted diet57 or restricted diet51), the between-group differences in adherence were not statistically significant at 12 months (90% vs. 100%, Fisher’s exact test p = 0.48)57 and 48 months post baseline (88% vs. 100%, Fisher’s exact test, p > 0.99)51 (review conclusion: inconclusive) (see Table 16).
Elemental nutrition versus drug
Randomised controlled trials
No evidence reported. 50
Non-randomised controlled trials
In one trial comparing elemental nutrition with sulfasalazine/prednisolone,51 the between-group differences in adherence at 48 months post baseline were not statistically significant (88% vs. 100%, Fisher’s exact test, p = 0.84) (review conclusion: inconclusive), see Table 16.
Elemental nutrition versus elemental nutrition plus drug
Randomised controlled trials
No trial carried out these comparisons.
Non-randomised controlled trials
In one trial comparing the elemental nutrition with the combination of elemental nutrition and sulfasalazine/prednisolone,51 the between-group differences in adherence at 48 months post baseline were not statistically significant (88.0% vs. 77.3%, Fisher’s exact test, p = 0.55) (review conclusion: inconclusive) (see Table 16).
Elemental nutrition plus drug compared with drug
Randomised controlled trials
No trial carried out these comparisons.
Non-randomised controlled trials
In one trial comparing the combination of elemental nutrition and sulfasalazine/prednisolone with sulfasalazine/prednisolone alone,51 the between-group differences in adherence at 48 months post baseline were not statistically significant (77.3% vs. 100.0%, Fisher’s exact test, p = 0.37). Another trial comparing the combination of elemental nutrition and infliximab versus infliximab alone58 reported 78% of adherence for the elemental nutrition group. No data were reported for the infliximab group (review conclusion: inconclusive) (see Table 16).
Elemental nutrition versus polymeric nutrition
Randomised controlled trials
The rate of adherence reported in one trial55 was significantly lower in the elemental nutrition versus polymeric nutrition group at 12 months after the baseline (68.4% vs. 100.0%, RR 0.68, 95% CI 0.50 to 0.92) (see Table 15).
Non-randomised controlled trials
No trial carried out these comparisons.
Withdrawal from steroids
Two of the eight28,50–52,55–58 included trials (one RCT55 and one nRCT56) reported the proportion of participants who withdrew from taking steroids. Results from both trials showed statistically non-significant differences in the withdrawals from steroids at 12 months post baseline between the groups of elemental nutrition and polymeric nutrition (42.1% vs. 42.8%, RR 0.98, 95% CI 0.44 to 2.19)55 or no intervention (unrestricted diet) (23.8% vs. 22.2%, RR 1.07, 95% CI 0.33 to 3.39)56 (review conclusion: inconclusive) (Tables 17 and 18).
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of RCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | NR52 | NR | 1 (NA) | No evidence |
| Elemental nutrition (with restricted diet) vs. 6-MP (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 24 | NR50 | NR | 1 (NA) | No evidence |
| Elemental nutrition (with unrestricted diet) vs. polymeric nutrition (with unrestricted diet) | ||||
| 12 | 8/19 (42.1) vs. 6/14 (42.8)55 | p = NR (NS), RR 0.98 (0.44 to 2.19)c | 1 (unclear RoB) | Inconclusive |
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of nRCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 5/21 (23.8) vs. 4/18 (22.2)56 | p = NR, RR 1.07 (0.33, 3.39)c | 1 (unclear RoB) | Inconclusive |
| Elemental nutrition (restricted diet) vs. NI (unrestricted diet) | ||||
| 6, 12, 60 | NR28 | NR | 1 (NA) | No evidence |
| 12 | NR57 | NR | 1 (NA) | No evidence |
| Elemental nutrition (restricted diet) vs. elemental nutrition/drugd (restricted diet) vs. drugd (restricted diet) vs. NI (restricted diet) | ||||
| 12, 24, 48 | NR51 | NR | 1 (NA) | No evidence |
| Elemental nutrition/druge (restricted diet) vs. druge (unrestricted diet) | ||||
| 14 | NR58 | NR | 1 (NA) | No evidence |
Steroid dose tapering
Only one trial (nRCT) reported this outcome. 56 At 12 months of follow-up, the difference in the proportion of participants whose steroid dose was tapered between those receiving elemental nutrition and those receiving no intervention (unrestricted diet) was not statistically significant (47.6% vs. 22.2%, RR 2.14, 95% CI 0.80 to 5.67) (review conclusion: inconclusive) (Table 19).
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of nRCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 10/21 (47.6) vs. 4/18 (22.2)56 | p = NR, RR 2.14 (0.80 to 5.67)c | 1 (unclear RoB) | Inconclusive |
| Elemental nutrition (restricted diet) vs. NI (unrestricted diet) | ||||
| 6, 12, 60 | NR28 | NR | 1 (NA) | No evidence |
| 12 | NR57 | NR | 1 (NA) | No evidence |
| Elemental nutrition (restricted diet) vs. elemental nutrition/drugd (restricted diet) vs. drugd (restricted diet) vs. NI (restricted diet) | ||||
| 12, 24, 48 | NR51 | NR | 1 (NA) | No evidence |
| Elemental nutrition/druge (restricted diet) vs. druge (unrestricted diet) | ||||
| 14 | NR58 | NR | 1 (NA) | No evidence |
Crohn’s Disease Activity Index
Two nRCTs57,58 reported incomplete data on 12- to 14-month post-treatment mean CDAI score (missing study group-specific means and variability parameters) and found significantly lower mean disease activity in favour of the elemental nutrition compared with the no intervention (unrestricted diet) group (p = 0.04)57 and a non-significant difference between the groups of elemental nutrition plus infliximab compared with infliximab alone (p > 0.05)58 (review conclusion: inconclusive) (Table 20).
| Follow-up (mean) | Arm-specific estimates, mean (SD or 95% CI) | Difference (p-value or 95% CI) | Number of nRCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | NR56 | NR | 1 (NA) | No evidence |
| Elemental nutrition (restricted diet) vs. NI (unrestricted diet) | ||||
| 6, 12, 60 | NR28 | NR | 1 (NA) | No evidence |
| 12 | NR57 | p = 0.04 (SS) in favour of elemental nutrition group | 1 (high RoB) | Inconclusive |
| Elemental nutrition (restricted diet) vs. elemental nutrition/drugc (restricted diet) vs. drugc (restricted diet) vs. NI (restricted diet) | ||||
| 12, 24, 48 | NR51 | NR | 1 (NA) | No evidence |
| Elemental nutrition/drugd (restricted diet) vs. drugd (unrestricted diet) | ||||
| 14 | NR58 | p > 0.05 (NS) | 1 (high RoB) | Inconclusive |
Health-related quality of life
Only one trial (RCT)52 reported any information on HRQoL. At 12 months of follow-up, the adjusted mean Inflammatory Bowel Disease Questionnaire (IBDQ) score did not differ between the participants receiving elemental nutrition and those receiving no intervention, i.e. on an unrestricted diet (171.9 vs. 176.7, p > 0.05) (Table 21).
| Follow-up (months) | Arm-specific estimates, mean (SD or 95% CI) | Difference (p-value or 95% CI) | Number of RCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 171.9 (126.4 to 217.3) vs. 176.7 (142.5 to 211.0)52 | Adjusted mean IBDQ score difference p > 0.05 (NS) | 1 (high RoB) | No difference |
| Elemental nutrition (with restricted diet) vs. 6-MP (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 24 | NR50 | NR | 1 (NA) | No evidence |
| Elemental nutrition (with unrestricted diet) vs. polymeric nutrition (with unrestricted diet) | ||||
| 12 | NR55 | NR | 1 (NA) | No evidence |
Adverse events and complications
For two RCTs reporting adverse events,50,52 no meaningful comparison was possible as the effect estimates could not be generated owing to zero counts in the nominators (review conclusion: inconclusive). For example, one trial reported the absence of adverse events52 and in the other trial,50 none of the 32 participants in the elemental nutrition group experienced any adverse event or complication. Of the 30 participants in the 6-MP group, two experienced elevated aspartate transaminase, one participant experienced hair loss and one participant experienced an abscess. Of the 33 participants in the no intervention group (unrestricted diet), one experienced elevated amylase but none of the participants in this group experienced any complication50 (Tables 22 and 23).
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of RCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 0/26 (0.0) vs. 0/25 (0.0)52 | 1 (low RoB) | Inconclusive | |
| Elemental nutrition (with restricted diet) vs. 6-MP (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| Elemental nutrition vs. 6-MP | Elemental nutrition vs. 6-MP | |||
| 24 | 0/32 (0.0) vs. 2/30 (6.6) (elevated AST) and 1/30 (3.1) (hair loss)50 | 1 (low RoB) | Inconclusive | |
| Elemental nutrition vs. NI | Elemental nutrition vs. NI | |||
| 24 | 0/32 (0.0) vs. 1/33 (3.0) (elevated amylase)50 | 1 (low RoB) | Inconclusive | |
| Elemental nutrition (with unrestricted diet) vs. polymeric nutrition (with unrestricted diet) | ||||
| 12 | NR55 | NR | 1 (NA) | No evidence |
| Follow-up (months) | Arm-specific estimates, n/N (%) | Difference (p-value or 95% CI) | Number of RCTs (SRoB across studies)a | Treatment effect conclusionb |
|---|---|---|---|---|
| Elemental nutrition (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| 12 | 0/26 (0.0) vs. 0/25 (0.0)52 | 1 (low RoB) | Inconclusive | |
| Elemental nutrition (with restricted diet) vs. 6-MP (with unrestricted diet) vs. NI (unrestricted diet) | ||||
| Elemental nutrition vs. 6-MP | Elemental nutrition vs. 6-MP | |||
| 24 | 0/32 (0.0) vs. 1/30 (3.1) (abscess)50 | 1 (low RoB) | Inconclusive | |
| Elemental nutrition vs. NI | Elemental nutrition vs. NI | |||
| 24 | 0/32 (0.0) vs. 0/33 (3.0)50 | 1 (low RoB) | Inconclusive | |
| Elemental nutrition (with unrestricted diet) vs. polymeric nutrition (with unrestricted diet) | ||||
| 12 | NR55 | NR | 1 (NA) | No evidence |
Cost-effectiveness of elemental diet
This review did not identify any study assessing cost-effectiveness of elemental nutrition. One RCT52,54 reported monthly costs for the two study groups of elemental nutrition and no intervention (i.e. free diet). This study was not an economic evaluation; therefore, no formal assessment of methodological quality of economic assessment was undertaken. In addition, there was not sufficient information on the cost data collection and analysis. According to a study report,54 the adjusted 1-year monthly cost treatments were not significantly different between the elemental nutrition and free diet groups (US$880.00 vs. US$600.00, p > 0.05). See cost outcomes in Appendix 2 for Takagi, 2009. 54
Rating the overall quality of evidence (Grading of Recommendations, Assessment, Development, and Evaluation system)
The overall quality ratings for each gradable outcome (i.e. maintenance of remission, risk of relapse, mucosal healing, need of surgery, withdrawal from steroids, steroid dose tapering, adherence and adverse events) are presented in the evidence profile table (Table 24).
| Outcome [follow-up (months)] | Number of studies reporting outcome (participants) | Pooled effect estimate (95% CI) and conclusion | SRoB across studies | Consistency | Directness | Precision | Outcome reporting bias | Quality of the evidence (GRADE)a |
|---|---|---|---|---|---|---|---|---|
| Elemental nutrition vs. NI (i.e. unrestricted/free diet): two RCTs50,52 | ||||||||
| Maintenance of remission (12) | 1 (65)50 | No pooled estimate, RR 1.37 (0.86 to 2.17), inconclusive | High SRoB | NA | Direct | Imprecise | Likely | Very low |
| Maintenance of remission (24) | 1 (65)50 | No pooled estimate, RR 2.06 (1.00 to 4.43), in favour of elemental nutrition | High SRoB | NA | Direct | Precise | Likely | Very low |
| Development of relapse/recurrence (12–24) | 2 (116)50,52 | Pooled estimate, RR 0.57 (0.38 to 0.84), in favour of elemental nutrition | Low SRoB | Consistent | Direct | Precise | Unlikely | High |
| Mucosal healing (NA) | 0 (0) | NA | NA | NA | NA | NA | NA | NA (no evidence) |
| Need of surgery (24) | 1 (65)50 | No pooled estimate, RR 1.03 (0.06 to 15.79), inconclusive | Low SRoB | NA | Direct | Imprecise | Likely | Very low |
| Withdrawal from steroids (NA) | 0 (0) | NA | NA | NA | NA | NA | NA | NA (no evidence) |
| Steroid dose tapering (NA) | 0 (0) | NA | NA | NA | NA | NA | NA | NA (no evidence) |
| Adherence (12) | 1 (51)52 | No pooled estimate, RR 0.96 (0.72 to 1.28), inconclusive | Low SRoB | NA | Direct | Imprecise | Likely | Very low |
| Adverse events (12–24) | 2 (116)50,52 | No pooled estimate, parameters not estimable, inconclusive | Low SRoB | Consistent | Direct | Imprecise | Unlikely | Moderate |
The overall quality of evidence for each gradable outcome was rated for the comparison between elemental nutrition and no intervention, given that two RCTs50,52 comparing elemental nutrition with no intervention (unrestricted diet) were judged to be the only potentially combinable evidence.
The overall quality ratings across the gradable outcomes for the above-mentioned comparison were as follows: maintenance of remission (grade: very low), risk of relapse (grade: high), need for surgery (grade: very low), adherence (grade: very low) and adverse events (grade: moderate). Mucosal healing, withdrawal from steroids and steroid dose tapering were not rated owing to the absence of evidence.
Summary of findings
The summary findings for each outcome and comparator are provided in Table 25. Limited evidence from two RCTs in patients with CD in remission50,52 has indicated a significant beneficial effect of elemental nutrition compared with no intervention (unrestricted diet) in maintaining remission after 24 months of follow-up (RR 2.06, 95% CI 1.00 to 4.43; very low-grade evidence50) and preventing the occurrence of relapse at 12–24 months of follow-up (pooled RR 0.57, 95% CI 0.38 to 0.84; high-grade evidence50,52). The shorter-term maintenance rate of remission (at 6 and 12 months) between the two randomised groups was not significantly different (12-month RR 1.37, 95% CI 0.86 to 2.17; very low-grade evidence; inconclusive result owing to wide 95% CIs). 50
| Conclusive evidence suggesting difference | Conclusive evidence suggesting no difference | Inconclusive evidence |
|---|---|---|
| Maintenance of remission (n/N) | ||
| Elemental nutrition vs. no intervention28,50–52,56,57 | ||
| At 24 months | None | At 6 and 12 months (NS) |
| One RCT50 | One RCT50 | |
| (RR 2.06, 95% CI 1.00 to 4.43; very low grade) | (Very low grade) | |
| In favour of elemental nutrition | At 12 months (NS) | |
| At 12–48 months | One nRCT56 | |
| Two nRCTs28,57 | At 48 months (SS = favoured elemental nutrition) | |
| RR 1.46, 95% CI 1.04 to 2.0530 | One nRCT51 | |
| RR 2.14, 95% CI 1.12 to 4.1057 | ||
| In favour of elemental nutrition | ||
| Elemental nutrition vs. drug50,51 | ||
| None | None | At 6, 12, 24 months (NS) |
| One RCT50 | ||
| At 48 months (SS = favoured elemental nutrition) | ||
| One nRCT51 | ||
| Elemental nutrition vs. elemental nutrition plus drug51 | ||
| None | None | At 48 months (NS) |
| One nRCT51 | ||
| Elemental nutrition plus drug vs. drug51,58 | ||
| None | None | At 14 months (NS) |
| One nRCT58 | ||
| At 48 months (SS = favoured elemental nutrition plus drug) | ||
| One nRCT51 | ||
| Elemental nutrition vs. polymeric nutrition55 | ||
| None | None | At 12 months (NS) |
| One RCT55 | ||
| Risk of relapse/recurrence (n/N) | ||
| Elemental nutrition vs. no intervention28,50–52,56,57 | ||
| At 12–24 months | None | At 60 months (NS) |
| Two RCTs50,52 | One nRCT28 | |
| (Pooled RR 0.57, 95% CI 0.38 to 0.84; I2 = 0%; high grade) | ||
| In favour of elemental nutrition | ||
| At 12 months | ||
| Three nRCTs28,56,57 | ||
| RR 0.42, 95% CI 0.20 to 0.88 | ||
| RR 0.50, 95% CI 0.25 to 0.98 | ||
| RR 0.38, 95% CI 0.16 to 0.87 | ||
| In favour of elemental nutrition | ||
| Elemental nutrition vs. drug50,51 | ||
| None | None | At 24 months (NS) |
| One RCT50 | ||
| Elemental nutrition plus drug vs. drug51,58 | ||
| None | None | At 14 months (NS) |
| One nRCT58 | ||
| Elemental nutrition vs. polymeric nutrition55 | ||
| None | None | At 12 months (NS) |
| One RCT55 | ||
| Time to relapse (number of months) | ||
| Elemental nutrition vs. no intervention28,50–52,56,57 | ||
| At 12 months | None | None |
| One nRCT56 | ||
| MD 1.20, 95% CI 0.35 to 2.04 | ||
| In favour of elemental nutrition | ||
| Mucosal healing (n/N) | ||
| Elemental nutrition vs. no intervention28,50–52,56,57 | ||
| None | None | At 12 months (NS) |
| One nRCT57 | ||
| Need for surgery (n/N) | ||
| Elemental nutrition vs. no intervention28,50–52,56,57 | ||
| None | None | At 24 months (NS) |
| One RCT50 | ||
| (Very low grade) | ||
| At 12 and 60 months (NS) | ||
| Two nRCTs28,57 | ||
| Elemental nutrition vs. drug50,51 | ||
| None | None | At 24 months (NS) |
| One RCT50 | ||
| Adherence (n/N) | ||
| Elemental nutrition vs. no intervention28,50–52,56,57 | ||
| At 12 and 60 months | None | At 12 months (NS) |
| Two nRCTs28,56 | One RCT52 | |
| RR 0.80, 95% CI 0.64 to 0.99 | (Very low grade) | |
| RR 0.81, 95% CI 0.65 to 0.99 | At 12 and 48 months (NS) | |
| In favour of no intervention | Two nRCTs51,57 | |
| Elemental nutrition vs. drug50,51 | ||
| None | None | At 48 months (NS) |
| One nRCT51 | ||
| Elemental nutrition vs. elemental nutrition plus drug51 | ||
| None | None | At 48 months (NS) |
| One nRCT51 | ||
| Elemental nutrition plus drug vs. drug51,58 | ||
| None | None | At 48 months (NS) |
| One nRCT51 | ||
| Elemental nutrition vs. polymeric nutrition55 | ||
| At 12 months | None | None |
| One RCT55 | ||
| RR 0.68, 95% CI 0.50 to 0.92 | ||
| In favour of polymeric nutrition | ||
| Withdrawal from steroids (n/N) | ||
| Elemental nutrition vs. no intervention28,50–52,56,57 | ||
| None | None | At 12 months (NS) |
| One nRCT56 | ||
| Elemental nutrition vs. polymeric nutrition55 | ||
| None | None | At 12 months (NS) |
| One RCT55 | ||
| Steroid dose tapering (n/N) | ||
| Elemental nutrition vs. no intervention28,50–52,56,57 | ||
| None | None | At 12 months (NS) |
| One nRCT56 | ||
| HRQoL (mean IBDQ score) | ||
| Elemental nutrition vs. no intervention28,50–52,56,57 | ||
| None | At 12 months (NS) | None |
| One RCT52 | ||
| 171.9 (95% CI 126.4 to 217.3) vs. 176.7 (95% CI 142.5 to 211.0) | ||
| In no favour of either intervention | ||
| Adverse events and complications (n/N) | ||
| Elemental nutrition vs. no intervention28,50–52,56,57 | ||
| None | None | At 12 and 24 months (estimates could not be generated) |
| Two RCTs50,52 | ||
| (Moderate grade) | ||
| Elemental nutrition vs. drug50,51 | ||
| None | None | At 24 months (estimate could not be generated) |
| One RCT50 | ||
Similarly, three nRCTs also showed significant benefits of elemental nutrition over no intervention (unrestricted diet) in maintaining remission at 12–48 months28,57 and preventing the occurrence of relapse at 12 months. 28,56,57 Evidence on the maintenance of remission from two nRCTs was rendered inconclusive owing to wide non-significant 95% CIs (RR 2.14, 95% CI 0.81 to 5.67)56 and missing data (i.e. effect estimates and/or 95% CIs). 51 In one nRCT,56 the use of elemental nutrition was associated with a significantly longer time to relapse than no intervention after 12 months of follow-up (MD 1.20, 95% CI 0.35 to 2.04).
According to one nRCT,57 the incidence of mucosal healing (endoscopic remission) at 12 months between patients receiving elemental nutrition compared with no intervention (unrestricted diet) was not significantly different (inconclusive results; RR 2.70, 95% CI 0.62 to 11.72).
Based on evidence from two nRCTs28,56 and one RCT,55 there was a significantly worse adherence rate in the elemental nutrition groups than either no intervention (unrestricted diet)28,56 or polymeric nutrition group (RR 0.68, 95% CI 0.50 to 0.92). 55
In general, evidence comparing the effects of elemental nutrition and active treatment(s) (sulfasalazine/prednisolone, infliximab, elemental nutrition, polymeric nutrition or combination) across the outcomes of interest yielded statistically non-significant results with wide 95% CIs implying possible moderate to large effect size treatment effects in both directions compatible both with benefit and harm from elemental nutrition (inconclusive results).
Evidence on complications and adverse events was too sparse (e.g. zero events, low counts) to derive effect estimates and 95% CIs and permit any meaningful comparison between the treatments.
There was no reported evidence on changes in anthropometric measures (e.g. body weight, height, BMI, linear growth rate) and pubertal development (Table 25).
Other analyses
Publication bias
The impact of publication bias on the pooled treatment effect estimates (i.e. degree of funnel plot asymmetry) could not be explored owing to an insufficient number of data points in the forest/funnel plots.
Subgroup effects
The reviewed evidence was too sparse and heterogeneous to allow exploration of whether or not the relative effect of elemental nutrition differed by study-level methodological (i.e. RoB, type of data analysis) or patient-related characteristics (i.e. age, gender or induction therapy).
Chapter 5 Discussion
Crohn’s disease is a chronic relapsing–remitting condition that causes chronic inflammation of the gastrointestinal tract. The clinical presentation of CD is often characterised by malnutrition, abdominal pain, diarrhoea and weight loss. 31 Despite the availability of a variety of therapeutic options used in the management of CD (medications, surgical or nutritional), none of these options leads to complete cure of this condition. 30 The main objective of any given management option is to induce and then maintain remission of disease activity by controlling the extent of inflammation, reducing clinical symptoms and preventing complications. Although corticosteroids are the most widely used drugs for the treatment of active CD, their use has been shown to be associated with short-term remission, steroid dependency, impairment in growth and risk of infections. 31
For the past two decades, nutritional therapy/enteral nutrition has been suggested as an effective treatment option in the management of CD in adults and children in terms of controlling CD activity. 29,35 For example, one meta-analysis indicated that enteral nutrition was at least as effective as steroids for inducing remission in children and young adults with active CD. 34 In contrast, a more recent review demonstrated that enteral nutrition given to adults was, in general, beneficial but less effective in inducing remission than steroids. 25 There has been little clarity regarding the role of enteral nutrition for maintaining remission in patients with quiescent CD. The relevant evidence has been scarce, mostly of an observational nature, and inconsistent in terms of findings. 31,35 Owing to its good safety profile and, if proved, being at least as effective as standard medical treatments, enteral nutrition would potentially replace or minimise the use of steroids, biologics and immunosuppressants. This in turn would lead to improved clinical outcomes, fewer adverse events in general and better growth rates and pubertal development in younger patients with CD. 33,35
The mechanism of action of elemental nutrition on CD is not known. Several hypothesised mechanisms underlying the proposed benefits of enteral nutrition in CD include reduced gut activity, reduction of antigenic load, nutritional effects, anti-inflammatory effects or modulation of immune system and gastrointestinal flora. 28–31
Main findings
This review systematically identified, appraised and synthesised relevant evidence on the comparative clinical effectiveness of elemental nutrition for maintaining remission in patients with CD. Limited evidence from two RCTs50,52 and three nRCTs28,56,57 has suggested that elemental nutrition (given orally or via feeding tube) was more effective for the maintenance of remission (at 12–48 months; very low-grade evidence based on RCTs) and prevention of relapse (at 12–24 months; high-grade evidence based on RCTs) compared with no treatment (i.e. unrestricted diet). Evidence from one nRCT also indicated that patients receiving elemental nutrition experienced longer mean time to relapse compared with patients in the no intervention group on unrestricted diet only. 56 The 12-month rates of adherence were lower in the elemental nutrition versus no intervention (i.e. unrestricted diet)28,56 or polymeric nutrition group. 55 This finding may be explained by the inconvenience of nasogastric feeding, poor palatability and/or higher cost of elemental nutrition compared with unrestricted diet and polymeric nutrition. 29,61 Limited evidence from one RCT52 demonstrated no difference in HRQoL between elemental nutrition and no intervention (unrestricted diet).
In general, comparisons of elemental nutrition to active treatments (sulfasalazine/prednisolone, infliximab, elemental nutrition, polymeric nutrition or combination) across the outcomes of interest were not statistically significant. These results should not be interpreted to mean that the treatments being compared are equivalent (or that there is an absence of effect of elemental nutrition). The associated 95% CIs tended to be so wide and uninformative as to include potential moderate-to-large treatment effects compatible with both benefit and harm of elemental nutrition; therefore, these results are inconclusive.
The data on complications and adverse events were too sparse (e.g. zero events, low counts) to derive effect estimates and 95% CIs or to permit any meaningful comparison between the treatments. The scarcity of reported adverse events and complications could be due to small samples, short-term follow-up, rarity of these events and/or under-reporting of such events.
For some reported evidence (e.g. cumulative probability of survival for being in remission) adequate interpretation was not possible owing to poor reporting or missing data (no summary effect measures, 95% CIs, SDs) and, therefore, was considered inconclusive.
Limitations of evidence
The review findings warrant cautious interpretation given the limitations of the evidence in terms of small trial size, methodological quality and RoB in individual trials (lack of blinding, short duration of follow-up, confounding).
For example, in the reviewed RCTs,50,52,55 the lack of blinding of participants, study personnel and/or outcome assessors may have led to systematic differences in care giving, administration of co-interventions and outcome assessments across the compared treatment groups. Generally, subjective measures such as those based on patient-reported outcomes including clinical symptoms (e.g. abdominal pain, number of soft stools, QoL or clinically defined remission/relapse) are more prone to bias than objective outcomes (e.g. endoscopic or biologically defined remission using serum/faecal biomarkers and radiography in addition to CDAI, adverse events and complications). Moreover, findings from one RCT50 may have been affected by selective outcome reporting bias.
Some of the results, especially in nRCTs, may have been biased as some known or unknown prognostic factors may have been distributed unevenly between the treatment groups. As for the known confounders, there was some between-group imbalance in two nRCTs with regards to induction therapy, location of the lesion and disease duration. 51,56 Moreover, in three nRCTs28,57,58 patients with ‘good compliance’ were assigned to elemental nutrition and those with ‘poor compliance’ to the control groups. Given that ‘good compliers’ may be inherently different from ‘poor compliers’ in clinical characteristics, this selective assignment could have distorted the group balance in some of these prognostic covariates (unclear RoB). Additional concern for confounding effects is justified because, in some of the studies, the use of concomitant drugs given for prophylaxis (e.g. 5-ASA, sulphasalazine, azathioprine, prednisolone) differed across the treatment groups in frequency/dose. 28,50,52,55,56,58
Additional limitations of the relevant evidence are worth mentioning. There was a lack of evidence of effects of elemental nutrition in young adolescents and children with CD in remission. The data reported on HRQoL, adverse events and complications were insufficient to allow any adequate conclusion. There was no relevant evidence for changes in anthropometric measures (weight, BMI, height, linear growth) and pubertal development. Given that all of the included studies evaluated elemental nutrition in addition to restricted or unrestricted diet, this review was unable to assess the clinical effectiveness and cost-effectiveness of an exclusive elemental nutrition in the maintenance of remission in patients with CD.
Comparison of current findings to previous systematic reviews
We identified two systematic reviews evaluating comparative clinical effectiveness of elemental nutrition in maintaining remission for patients with CD. 30,35 The Cochrane review’s eligibility criterion for design was set to RCTs (included two RCTs). 30 The study eligibility for the other systematic review was wider and encompassed RCTs, prospective nRCTs and retrospective observational cohort studies (included one RCT, three nRCTs, and six retrospective cohort studies). 35 All potentially eligible trials included in the two systematic reviews were also included in the present review. In general, findings of this review are in agreement with those from other two systematic reviews in showing benefits of elemental nutrition compared with no intervention (i.e. unrestricted diet) in maintaining remission among patients with CD. In agreement with our review, findings in relation to the comparison between elemental and polymeric nutrition were inconclusive. 30
Strengths and limitations of current review
One of the strengths of this review is that we used systematic, comprehensive and independent strategies to minimise bias in searching, identifying, selecting, extracting and appraising the primary studies. The search strategy was applied to multiple electronic sources, relevant websites, as well as reference lists of potentially eligible publications were searched. Moreover, this review included a higher hierarchy of evidence (i.e. randomised and nRCTs).
This review has its own limitations. The presence of clinical heterogeneity (e.g. population characteristics, induction therapy), potential for confounding (especially in nRCTs) and poor reporting (missing data on outcomes) led to limitations for pooling the results across studies. As this review included only English-language full-text publications, the effects of publication bias cannot be ruled out. Given the insufficient number of pooled studies (data points), this effect could not be investigated via funnel plots. Likewise, the paucity of data did not allow exploration of whether or not there was any variation in treatment effect across the pre-defined subgroups of patients or methodological features of studies.
Applicability of findings and implications for clinical practice and policy-making
It is not usually easy to determine the extent to which studies are applicable to a broader context of routine clinical practice in a given geographical place and this is true in this case for extrapolating to the UK for a number of reasons. This process of ascertaining applicability is hindered by poor reporting, selective eligibility criteria and enrolment, non-participation and differences between treatments and outcomes used in research compared with those used in routine clinical practice. Specifically, the extent of applicability of this review’s findings to clinical practice in the UK may be limited, as six of the eight included studies were conducted in Japan28,50–52,57,58 and only two in the UK. 55,56 The trials reviewed may have been overly selective in enrolling and assigning patients to treatments, thereby leading to samples that are not representative of patients with CD in remission who would be encountered in daily clinical practice. Patient adherence is important for successful treatment with elemental nutrition; however, if studies have reported the effects of elemental nutrition in only good compliers, this will also limit the applicability of findings to a broader group of patients. As all included studies investigated adult patients, the conclusions regarding the benefits of elemental nutrition in maintaining remission of CD may not be readily applicable to younger patients (< 18 years old). Most results were based on outcomes ascertained at 12–24 months of follow-up and the conclusions of the review regarding longer-term benefits were indeterminate and cannot be extrapolated. Finally, our findings may not be readily applicable to patients receiving exclusive elemental nutrition, as the evidence available to us, and which we reviewed, presented only those scenarios in which elemental nutrition was given in addition to diet. In summary, we would advise caution in attempting to extrapolate the findings of this review to practice in the UK and would recommend that further research is required, see Research recommendations.
Implications for future research
Future research needs to address clinical, methodological and reporting limitations highlighted in the identified reviewed evidence. In general, more high-quality evidence (i.e. long-term well-powered RCTs) is needed to determine definitively the clinical benefits, risks and cost-effectiveness of elemental nutrition compared with no treatment (restricted or unrestricted diet), other types of enteral nutrition, and standard drug treatment for maintaining remission of CD in adults and children.
Research recommendations
Future research recommendations listed according to the PICO (Population, Intervention, Comparator, Outcome) framework along with corresponding limitations, which are as follows:
Population
Limitation(s): there is little relevant evidence on clinical effectiveness and harms of elemental nutrition compared with other treatments for maintaining remission in adults with CD. There is no such evidence in young adults and children.
Recommendation(s): in future, more studies investigating clinical benefits and risks of elemental nutrition in maintaining CD remission in these populations, especially in young adults and children, are needed. Ideally, future studies would explore the effect of elemental nutrition across specific population subgroups defined by age, gender, duration/location of CD and type of induction therapy.
Intervention
Limitation(s): in the reviewed studies, elemental nutrition was given in addition to unrestricted or restricted diet. Thus, none of the studies evaluated the effect of exclusive elemental nutrition in relation to the maintenance of CD remission. The adherence of participants to elemental nutrition needs to be maximised.
Recommendation(s): studies exploring the clinical effectiveness and cost-effectiveness of exclusive elemental nutrition are needed. More research exploring better tasting formulas to increase the adherence rate to elemental nutrition feeding is also warranted.
Comparator
Limitation(s): there is insufficient evidence (i.e. small number of studies) comparing benefits and risks of elemental nutrition to no treatment (restricted or unrestricted diet) or standard drug treatment for maintaining remission of CD. This review identified only one study comparing different types of enteral nutrition (elemental vs. polymeric).
Recommendation(s): future studies should compare the clinical effectiveness and cost-effectiveness and harms of elemental nutrition to standard drugs (e.g. azathioprine, mercaptopurine, methotrexate, infliximab, sulfasalazine) and other types of enteral nutrition (polymeric, semi-elemental) for maintaining remission in CD.
Outcome
Limitation(s): there is a lack of studies that evaluated cost-effectiveness of elemental nutrition compared with other treatments for maintaining remission in CD. None of the included studies reported changes in anthropometric measures (weight, BMI, height, linear growth) and pubertal development. HRQoL was reported for one study52 and adverse events and complications for two studies. 50,52
Recommendation(s): studies investigating cost-effectiveness of elemental nutrition are needed. Investigators designing future studies should measure and report adequately defined adverse events and complications. Ideally, subjective outcomes measuring the maintenance of remission/incidence of relapse (e.g. clinically defined, CD activity index score based) should also be supplemented with objective outcomes (e.g. endoscopic remission).
Methodological quality of evidence
Limitation(s): the quality of this evidence is limited (RoB owing to blinding, small samples, short follow-up, confounding in nRCTs).
Recommendation(s): large well-powered and long-term RCTs utilising different blinding techniques for study participants, personnel and outcome assessors are needed. Investigators involved in the conduct of RCTs need to ensure that the use of concomitant drugs or any other intervention be evenly distributed across the randomised groups to minimise the effects of confounding.
Reporting quality
Limitation(s): the reporting quality of included studies was poor.
Recommendation(s): health-care community need to improve reporting practices in relation to trial methodology (e.g. methods of treatment assignment, blinding, power analysis, statistical analysis) as well as completeness of reported data (missing effect estimates, 95% CIs, adverse events, complications) for better interpretability of evidence.
Chapter 6 Conclusions
This systematic review assessed the comparative clinical effectiveness and cost-effectiveness of elemental nutrition for the maintenance of remission in patients with CD based on evidence from eight prospective controlled studies. 28,50–52,55–58 Overall, the findings warrant cautious interpretation given the limited amount of evidence (small number of studies), methodological shortcomings (short-term follow-up, small studies), poor reporting (missing data, partial reporting of data) and role of bias which cannot be ruled out (adherence to elemental nutrition, confounding, lack of blinding). Given these caveats, the results from five studies28,50,52,56,57 indicated significant benefits of elemental nutrition (given orally or via feeding tube) in maintaining remission and preventing relapse compared with no intervention (i.e. unrestricted diet) at 12–48 months of follow-up. A limited amount of evidence showed greater patient adherence rates for unrestricted or polymeric nutrition groups compared with an elemental nutrition group at 12-month follow-up. 28,55,56 According to evidence from one trial,52 there was no difference in HRQoL between patients receiving an elemental compared with an unrestricted diet after 12 months of follow-up. In general, effect estimates for most outcomes across comparisons between elemental nutrition and active treatments (e.g. prednisolone) were statistically non-significant accompanied by a great degree of uncertainty (very wide 95% CIs) and, therefore, were rendered inconclusive. There was a lack or insufficient evidence on adverse events and complications and no evidence on cost-effectiveness. There was no similar evidence reported for children or younger patients with CD in remission. The applicability of the review findings to clinical practice in the UK may be limited, as six of the eight included studies were conducted in Japan28,50–52,57,58 and only two in the UK. 55,56 The trials may have been overly selective in enrolling patients to treatments, thereby leading to unrepresentative samples of patients with CD in remission. Future large and long-term randomised trials are warranted to draw more definitive conclusions regarding the effects of elemental nutrition in maintaining remission in CD.
Acknowledgements
The authors would like to thank our clinical advisors who have assisted with protocol development and provision of a clinical perspective on identified evidence. Clinical advisors included Dr Ramesh Arasaradnam, Gastroenterology, University Hospital, Coventry, and Professor Simon Murch, Professor of Paediatrics, Warwick Medical School, Coventry.
Contributions of authors
Alexander Tsertsvadze (Senior Research Fellow), Tara Gurung (Research Fellow) and Paul Sutcliffe (Associate Professor) conducted the systematic review, which included screening and retrieving papers, assessing against the inclusion criteria, appraising the quality of papers and abstracting data from papers for synthesis.
Rachel Court (Information Specialist) developed the search strategy and undertook searches.
Aileen Clarke (Professor in Public Health Research) wrote sections of the abstract, executive summary and discussion and provided comments throughout.
Paul Sutcliffe co-ordinated the report.
All authors were involved in writing the draft and final versions of the report.
Disclaimers
This report presents independent research funded by the National Institute for Health Research (NIHR). The views and opinions expressed by authors in this publication are those of the authors and do not necessarily reflect those of the NHS, the NIHR, NETSCC, the HTA programme or the Department of Health. If there are verbatim quotations included in this publication the views and opinions expressed by the interviewees are those of the interviewees and do not necessarily reflect those of the authors, those of the NHS, the NIHR, NETSCC, the HTA programme or the Department of Health.
References
- Donnellan CF, Yann LH, Lal S. Nutritional management of Crohn’s disease. Ther Adv Gastroenterol 2013;6:231-42. http://dx.doi.org/10.1177/1756283X13477715.
- American College of Gastroenterology . Advancing Gastroenterology Ipc. Inflammatory Bowel Disease n.d. http://patients.gi.org (accessed 28 October 2013).
- Sandhu BK, Fell JM, Beattie RM, Mitton SG, Wilson DC, Jenkins H. Guidelines for the management of inflammatory bowel disease in children in the United Kingdom. J Pediatr Gastroenterol Nutr 2010;50:S1-13. http://dx.doi.org/10.1097/MPG.0b013e3181c92c53.
- Sartor RB. Mechanisms of disease: pathogenesis of Crohn’s disease and ulcerative colitis. Nat Clin Pract Gastroenterol Hepatol 2006;3:390-407. http://dx.doi.org/10.1038/ncpgasthep0528.
- Living With Crohn’s Disease The Real Impact. St Albans, UK: The Association; 2007.
- Akobeng AK. Crohn’s disease: current treatment options. Arch Dis Child 2008;93:787-92. http://dx.doi.org/10.1136/adc.2007.128751.
- National Institute for Health and Clinical Excellence (NICE) . NICE Clinical Guideline 152: Crohn’s Disease: Management in Adults, Children and Young People 2012. www.nice.org.uk/CG152 (accessed 24 October 2013).
- Lichtenstein GR, Hanauer SB, Sandborn WJ. Management of Crohn’s disease in adults. Am J Gastroenterol 2009;104:465-83. http://dx.doi.org/10.1038/ajg.2008.
- Bernstein CN, Fried M, Krabshuis JH. World Gastroenterology Organisation (WGO) Global Guidelines. Inflammatory Bowel Disease: A Global Perspective. 2009. www.worldgastroenterology.org (accessed 25 October 2013).
- BUPA . Crohn’s Disease n.d. www.bupa.co.uk/health-information/directory/c/crohns-disease (accessed 25 October 2013).
- Binder V, Hendriksen C, Kreiner S. Prognosis in Crohn’s disease – based on results from a regional patient group from the county of Copenhagen. Gut 1985;26:146-50. http://dx.doi.org/10.1136/gut.26.2.146.
- Cohen RD. The quality of life in patients with Crohn’s disease. Aliment Pharmacol Ther 2002;16:1603-9. http://dx.doi.org/10.1046/j.1365-2036.2002.01323.x.
- Canavan C, Abrams KR, Hawthorne B, Drossman D, Mayberry JF. Long-term prognosis in Crohn’s disease: factors that affect quality of life. Aliment Pharmacol Ther 2006;23:377-85. http://dx.doi.org/10.1111/j.1365-2036.2006.02753.x.
- Canavan C, Abrams KR, Hawthorne B, Mayberry JF. Long-term prognosis in Crohn’s disease: an epidemiological study of patients diagnosed more than 20 years ago in Cardiff. Aliment Pharmacol Ther 2007;25:59-65.
- Talley NJ, Abreu MT, Achkar JP, Bernstein CN, Dubinsky MC, Hanauer SB, et al. An evidence-based systematic review on medical therapies for inflammatory bowel disease. Am J Gastroenterol 2011;106:S2-25. http://dx.doi.org/10.1038/ajg.2011.58.
- Hovde O, Moum BA. Epidemiology and clinical course of Crohn’s disease: results from observational studies. World J Gastroenterol 2012;18:1723-31. http://dx.doi.org/10.3748/wjg.v18.i15.1723.
- Mayberry JF, Lobo A, Ford AC, Thomas A. NICE clinical guideline (CG152): the management of Crohn’s disease in adults, children and young people. Aliment Pharmacol Ther 2013;37:195-203. http://dx.doi.org/10.1111/apt.12102.
- Sica GS, Biancone L. Surgery for inflammatory bowel disease in the era of laparoscopy. World J Gastroenterol 2013;19:2445-8. http://dx.doi.org/10.3748/wjg.v19.i16.2445.
- Lloyd DK, JY, Kumar D, Maxwell JD, Ellis C, Tinto A, et al. Crohn’s Disease and Ulcerative Colitis: Divergent Trends in Hospital Admission Rates 1989/90 to 1999/2000. Health Stat Q 2002. www.ons.gov.uk/ons/rel/hsq/health-statistics-quarterly/no--16--winter-2002/crohn-s-disease-and-ulcerative-colitis--divergent-trends-in-hospital-admission-rates--1989-90-to-1999-2000.pdf (accessed 25 October 2013).
- Lichtenstein GR. Emerging prognostic markers to determine Crohn’s disease natural history and improve management strategies: a review of recent literature. Gastroenterol Hepatol 2010;6:99-107.
- Bassi A, Dodd S, Williamson P, Bodger K. Cost of illness of inflammatory bowel disease in the UK: a single centre retrospective study. Gut 2004;53:1471-8. http://dx.doi.org/10.1136/gut.2004.041616.
- Freeman HJ. Use of the Crohn’s disease activity index in clinical trials of biological agents. World J Gastroenterol 2008;14:4127-30. http://dx.doi.org/10.3748/wjg.14.4127.
- Baumgart DC, Sandborn WJ. Crohn’s disease. Lancet 2012;380:1590-605. http://dx.doi.org/10.1016/S0140-6736(12)60026-9.
- Hanauer SB, Sandborn W. Management of Crohn’s disease in adults. Am J Gastroenterol 2001;96:635-43. http://dx.doi.org/10.1111/j.1572-0241.2001.03671.x.
- Zachos M, Tondeur M, Griffiths AM. Enteral nutritional therapy for induction of remission in Crohn’s disease. Cochrane Database Syst Rev 2007;1.
- Makola D. Elemental and semi-elemental formulas: are they superior to polymeric formulas?. Pract Gastroenterol 2005;14:59-64.
- Chen QP. Enteral nutrition and acute pancreatitis. World J Gastroenterol 2001;7:185-92.
- Yamamoto T, Nakahigashi M, Umegae S, Kitagawa T, Matsumoto K. Impact of long-term enteral nutrition on clinical and endoscopic recurrence after resection for Crohn’s disease: a prospective, non-randomised, parallel, controlled study. Aliment Pharmacol Ther 2007;25:67-72. http://dx.doi.org/10.1111/j.1365-2036.2006.03158.x.
- Day AS, Otley AR. Exclusive enteral nutrition: a nutritional approach to Crohn’s disease. Pract Gastroenterol 2009;33:34-40.
- Akobeng AK, Thomas AG. Enteral nutrition for maintenance of remission in Crohn’s disease. Cochrane Database Syst Rev 2009;3.
- Alhagamhmad MH, Day AS, Lemberg DA, Leach ST. An update of the role of nutritional therapy in the management of Crohn’s disease. J Gastroenterol 2012;47:872-82. http://dx.doi.org/10.1007/s00535-012-0617-9.
- Critch J, Day AS, Otley A, King-Moore C, Teitelbaum JE, Shashidhar H, et al. Use of enteral nutrition for the control of intestinal inflammation in paediatric Crohn disease. J Paediatr Gastroenterol Nutr 2012;54:298-305. http://dx.doi.org/10.1097/MPG.0b013e318235b397.
- Wilschanski M, Sherman P, Pencharz P, Davis L, Corey M, Griffiths A. Supplementary enteral nutrition maintains remission in paediatric Crohn’s disease. Gut 1996;38:543-8. http://dx.doi.org/10.1136/gut.38.4.543.
- Heuschkel RB, Menache CC, Megerian JT, Baird AE. Enteral nutrition and corticosteroids in the treatment of acute Crohn’s disease in children. J Paediatr Gastroenterol Nutr 2000;31:8-15. http://dx.doi.org/10.1097/00005176-200007000-00005.
- Yamamoto T, Nakahigashi M, Umegae S, Matsumoto K. Enteral nutrition for the maintenance of remission in Crohn’s disease: a systematic review. Eur J Gastroenterol Hepatol 2010;22:1-8. http://dx.doi.org/10.1097/MEG.0b013e32832c788c.
- Lochs H, Dejong C, Hammarqvist F, Hebuterne X, Leon-Sanz M, Schutz T, et al. ESPEN guidelines on enteral nutrition: gastroenterology. Clin Nutr 2006;25:260-74. http://dx.doi.org/10.1016/j.clnu.2006.01.007.
- Sutcliffe P, Tsertsvadze A, Court R, Pulikottil-Jacob R, Kandala N-B, Gurung T, et al. Elemental Nutrition for Crohn’s Disease 2013. www.crd.york.ac.uk/PROSPERO/display_record.asp?ID=CRD42013005134 (accessed 25 October 2013).
- Rajendran N, Kumar D. Role of diet in the management of inflammatory bowel disease. World J Gastroenterol 2010;16:1442-8. http://dx.doi.org/10.3748/wjg.v16.i12.1442.
- Hunter J. The Official Website of Professor John Hunter – Everything You’ll Ever Need to Know About IBD: Crohn’s Disease (CD) n.d. http://crohns.nutricia.co.uk/crohns_disease (accessed 25 October 2013).
- Crohn’s in Childhood Research Association (CICRA) . What Is IBD: Children With Crohn’s Disease n.d. www.cicra.org/what-is-ibd/children-with-crohns-disease (accessed 14 November 2013).
- Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. Ann Intern Med 2009;151:264-9. http://dx.doi.org/10.7326/0003-4819-151-4-200908180-00135.
- Higgins JP, Altman DG, Gotzsche PC, Juni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ 2011;343. http://dx.doi.org/10.1136/bmj.d5928.
- Drummond M, Sculpher M, Torrance G. Methods for the Economic Evaluation of Health Care Programmes. Oxford: Oxford University Press; 2005.
- DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials 1986;7:177-88. http://dx.doi.org/10.1016/0197-2456(86)90046-2.
- Higgins J, Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 2011. www.cochrane-handbook.org (accessed 1 October 2013).
- Egger M, Davey Smith G, Schneider M, Minder C. Bias in meta-analysis detected by a simple, graphical test. BMJ 1997;315:629-34. http://dx.doi.org/10.1136/bmj.315.7109.629.
- Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ (Clinical Research Ed) 2008;336:924-6. http://dx.doi.org/10.1136/bmj.39489.470347.AD.
- Guyatt G, Oxman AD, Akl EA, Kunz R, Vist G, Brozek J, et al. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables. J Clin Epidemiol 2011;64:383-94. http://dx.doi.org/10.1016/j.jclinepi.2010.04.026.
- Guyatt GH, Oxman AD, Sultan S, Glasziou P, Akl EA, Alonso-Coello P, et al. GRADE guidelines: 9. Rating up the quality of evidence. J Clin Epidemiol 2011;64:1311-16. http://dx.doi.org/10.1016/j.jclinepi.2011.06.004.
- Hanai H, Iida T, Takeuchi K, Arai H, Arai O, Abe J, et al. Nutritional therapy versus 6-mercaptopurine as maintenance therapy in patients with Crohn’s Disease. Dig Liver Dis 2012;44:649-54. http://dx.doi.org/10.1016/j.dld.2012.03.007.
- Hirakawa H, Fukuda Y, Tanida N, Hosomi M, Shimoyama T. Home elemental enteral hyperalimentation (HEEH) for the maintenance of remission in patients with Crohn’s disease. J Gastroenterol 1993;28:379-84.
- Takagi S, Utsunomiya K, Kuriyama S, Yokoyama H, Takahashi S, Iwabuchi M, et al. Effectiveness of an ‘half elemental diet’ as maintenance therapy for Crohn’s disease: a randomised-controlled trial. Aliment Pharmacol Ther 2006;24:1333-40. http://dx.doi.org/10.1111/j.1365-2036.2006.03120.x.
- Takagi S, Utsunomiya K, Kuriyama S, Yokoyama H, Takahashi S, Iwabuchi M, et al. Efficacy of ‘half elemental diet’ as a maintenance therapy for Crohn’s disease: Crohn’s disease half elemental diet study in Sendai (CHESS): a randomised controlled trial. Gastroenterology 2006;130.
- Takagi S, Utsunomiya K, Kuriyama S, Yokoyama H, Takahashi S, Umemura K, et al. Quality of life of patients and medical cost of ‘half elemental diet’ as maintenance therapy for Crohn’s disease: secondary outcomes of a randomised controlled trial. Dig Liver Dis 2009;41:390-4. http://dx.doi.org/10.1016/j.dld.2008.09.007.
- Verma S, Holdsworth CD, Giaffer MH. Does adjuvant nutritional support diminish steroid dependency in Crohn disease?. Scand J Gastroenterol 2001;36:383-8. http://dx.doi.org/10.1080/003655201300051199.
- Verma S, Kirkwood B, Brown S, Giaffer MH. Oral nutritional supplementation is effective in the maintenance of remission in Crohn’s disease. Dig Liver Dis 2000;32:769-74. http://dx.doi.org/10.1016/S1590-8658(00)80353-9.
- Yamamoto T, Nakahigashi M, Saniabadi AR, Iwata T, Maruyama Y, Umegae S, et al. Impacts of long-term enteral nutrition on clinical and endoscopic disease activities and mucosal cytokines during remission in patients with Crohn’s disease: a prospective study. Inflamm Bowel Dis 2007;13:1493-501. http://dx.doi.org/10.1002/ibd.20238.
- Yamamoto T, Nakahigashi M, Umegae S, Matsumoto K. Prospective clinical trial: enteral nutrition during maintenance infliximab in Crohn’s disease. J Gastroenterol 2010;45:24-9. http://dx.doi.org/10.1007/s00535-009-0136-5.
- Yamamoto T, Shiraki M, Nakahigashi M, Umegae S, Matsumoto K. Enteral nutrition to suppress postoperative Crohn’s disease recurrence: a five-year prospective cohort study. Int J Colorectal Dis 2013;28:335-40. http://dx.doi.org/10.1007/s00384-012-1587-3.
- Yamamoto T, Shiraki M, Umegae S, Matsumoto K. The long-term efficacy of enteral nutrition for the prevention of postoperative recurrence in Crohn’s disease: a five-year prospective cohort study. J Crohn’s Colitis 2013;7:S146-S7. http://dx.doi.org/10.1016/S1873-9946(13)60363-3.
- Yamamoto T, Nakahigashi M, Saniabadi AR. Dietary interventions in patients with inflammatory bowel disease. Pract Gastroenterol 2011;35:10-26. http://dx.doi.org/10.1111/j.1365-2036.2009.04035.x.
- Wardle TD, Hall L, Turnberg LA. Use of coculture of colonic mucosal biopsies to investigate the release of eicosanoids by inflamed and uninflamed mucosa from patients with inflammatory bowel disease. Gut 1992;33:1644-51. http://dx.doi.org/10.1136/gut.33.12.1644.
Appendix 1 Search strategies
MEDLINE (Ovid)
Searched: 1946 to August 2013 (searched on 29 August 2013).
-
Crohn Disease/
-
Inflammatory Bowel Diseases/
-
crohn*.tw.
-
Inflammatory bowel disease*.tw.
-
1 or 2 or 3 or 4
-
((Enteral or elemental or chemically defined) and (Nutrition$or diet$or therap$or feed$or formula$)).tw.
-
Enteral Nutrition/
-
Food, Formulated/
-
6 or 7 or 8
-
(remission* or inactiv* or quiescen* or relaps* or recurr* or maintenan*).tw
-
disease-free survival/
-
10 or 11
-
5 and 9 and 12
-
limit 13 to English language
EMBASE
Searched: 1947 to August 2013 (searched on 29 August 2013).
-
Crohn disease/
-
crohn*.tw.
-
Inflammatory bowel disease*.tw.
-
1 or 2 or 3
-
((Enteral or elemental or chemically defined) and (nutrition$or diet$or therap$or feed$or formula$)).tw.
-
enteric feeding/
-
elemental diet/
-
5 or 6 or 7
-
(remission* or inactiv* or quiescen* or relaps* or recurr* or maintenan*).tw.
-
disease free survival/
-
9 or 10
-
4 and 8 and 11
-
limit 12 to English language
MEDLINE In-Process & Other Non-Indexed Citations (Ovid)
Searched: August 2013 (searched on 29 August 2013).
-
crohn*.tw.
-
Inflammatory bowel disease*.tw.
-
1 or 2
-
((Enteral or elemental or chemically defined) and (Nutrition$or diet$or therap$or feed$or formula$)).tw.
-
Enteral Nutrition.tw.
-
Food, Formulated.tw.
-
4 or 5 or 6
-
(remission* or inactiv* or quiescen* or relaps* or recurr* or maintenan*).tw.
-
disease-free survival.tw.
-
8 or 9
-
3 and 7 and 10
-
limit 11 to English language
Science Citation Index and Conference Proceedings via the Web of Science
Searched on 29 August 2013.
Topic= (crohn* or Inflammatory bowel disease or Crohn Disease) and (Enteral or elemental or chemically defined or Nutrition* or diet* or therap* or feed* or formula* or Enteral Nutrition or Food, Formulated) and (remission* or inactiv* or quiescen* or relaps* or recurr* or maintenan* or disease-free survival)
The Cochrane Library
Searched on 4 September 2013.
#1 Medical subject heading (MeSH) descriptor: [Crohn Disease] this term only
#2 MeSH descriptor: [Inflammatory Bowel Diseases] this term only
#3 (crohn*):ti,ab,kw
#4 (Inflammatory bowel disease*):ti,ab,kw
#5 (#1 or #2 or #3 or #4)
#6 (#1 or #2)
#7 ((Enteral or elemental or chemically defined) and (Nutrition$or diet$or therap$or feed$or formula$)):ti,ab,kw
#8 MeSH descriptor: [Enteral Nutrition] this term only
#9 MeSH descriptor: [Food, Formulated] this term only
#10 (#7 or #8 or #9)
#11 (remission* or inactiv* or quiescen* or relaps* or recurr* or maintenan*):ti,ab,kw
#12 MeSH descriptor: [Disease-Free Survival] this term only
#13 (#11 or #12)
#14 (#5 and #10 and #13)
All Results (61)
Cochrane Reviews (4)
All
Review
Protocol
Other Reviews (5)
Trials (52)
Methods Studies (0)
Technology Assessments (0)
Economic Evaluations (0)
Cochrane Groups (0)
Trial database
World Health Organization International Clinical Trials Registry Platform
Searched on 20 September 2013.
8 records for 8 trials found for: crohn* and element*
3 records for 3 trials found for: inflammatory bowel disease* and element*
13 records for 12 trials found for: crohn* and enteral*
2 records for 2 trials found for: inflammatory bowel disease* and enteral*
Total: 25
Total after duplicates removed: 21
Total after initial sifting by RC: 3
Total after check by AT and TG: 0
UK Clinical Research Network study portfolio
Topic: all
AND
Research summary: inflammatory bowel diseases elemental (all terms)
OR
Research summary: inflammatory bowel disease elemental (all terms)
OR
Research summary: inflammatory bowel diseases enteral (all terms)
OR
Research summary: inflammatory bowel disease enteral (all terms)
OR
Research summary: crohn elemental (all terms)
OR
Research summary: crohn enteral (all terms)
OR
Research summary: crohn’s elemental (all terms)
OR
Research summary: crohn’s enteral (all terms)
Total: 1
Total after sifting by RC: 0
Appendix 2 Full data extraction of included primary study reports
Randomised controlled trials
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Tara Gurung
| Study details | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| First author surname year of publication: Hanai 201250 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Country: Japan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study design: RCT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study setting (primary care/specialty clinic/other – specify): specialty clinic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of centres: one | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total length of follow-up: 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Funding (government/private/manufacturer/other – specify): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aim of the study | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| To evaluate the efficacy of elemental nutrition versus 6-MP as maintenance therapy in CD | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Participants | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Recruitment dates: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients who received induction therapy: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients achieving remission after induction therapy: 105 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients unable to achieve remission after induction therapy: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients excluded before start of maintenance therapy (e.g. in relapse, lost to follow-up): 10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients allocated to maintenance treatment: 95 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inclusion criteria: age ≥18 years who achieved remission (CDAI score < 150 points) within 30 days of entry to this trial | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Exclusion criteria: patients with abdominal abscess, stricture (B1 of Vienna and Montreal classification), pregnant women, patients with cardiovascular disorders and history of intolerance to 6-MP | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Characteristics of participants (total study sample) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean (range or SD) age (years): mean range 29.8–32.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Women [n (%)]: 25/95 (26.3) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Race/ethnicity [n (%)]: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diagnostic criteria for CD: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean CDAI score (points) (range or SD): mean range 89.9–103.4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD location [n (%)]: ileocolic type [59/95 (62.2)], ileal type [27/95 (28.4)], colic type [8/95 (8.4)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Type of induction therapy (e.g. medical, surgical): parenteral nutrition [70/95 (73.7)], central venous feeding [25/95 (26.3)], prednisolone [9/95 (9.5)], infliximab [4/95 (4.2)], 6-MP [14/95 (14.7)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous surgery [n (%)]: 19/95 (20.0) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group: elemental nutrition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 2 group: 6-MP | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group: no intervention | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Outcomes (study based) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primary outcomes (list): remission maintenance rate, risk of relapse | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Measure of disease activity (clinical, endoscopic): CDAI score | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of remission (clinical, endoscopic): CDAI score of < 150 points | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of relapse/recurrence (clinical, endoscopic): clinical (CDAI score of ≥ 200 points or the need for an additional medication to suppress worsening symptoms) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of mucosal healing (clinical, endoscopic): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline timings of primary outcome assessment: 6, 12, 18, 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of patients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TotalElemental nutrition group6-MP groupNo intervention groupAllocated to treatment95323033Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one)95 (ITT)323033Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one)11524ITT, intention to treat; PP, per protocol. | Total | Elemental nutrition group | 6-MP group | No intervention group | Allocated to treatment | 95 | 32 | 30 | 33 | Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 95 (ITT) | 32 | 30 | 33 | Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 11 | 5 | 2 | 4 | ITT, intention to treat; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total | Elemental nutrition group | 6-MP group | No intervention group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allocated to treatment | 95 | 32 | 30 | 33 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 95 (ITT) | 32 | 30 | 33 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 11 | 5 | 2 | 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ITT, intention to treat; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Interventions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration)DietCo-interventionElemental nutrition groupElental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) at ≥ 900 kcal/day, taken via self-inserted feeding tube (2 patients) or by oral intake (32 patients)5-ASA (n = NR; 5-ASA, 2250–3000 mg/day)Restricted diet: patients were allowed an intake of 3.5–4.0 kcal/kg/day from food as recommended by a qualified dietitianSulphasalazine (n = NR; 3000 mg/day)Duration: 24 monthsDuration: 24 months6-MP groupStarting dose 20 mg/day (weight< 45 kg)5-ASA (n = NR; 5-ASA, 2250–3000 mg/day)Starting dose 30 mg/day (weight ≥ 45 kg)Sulphasalazine (n = NR; 3000 mg/day)Within 8–12 weeks of the initial dosing, if 6-TGN level ≤ 200 pmol/8 × 108 RBC, the dose of 6-MP could be increased by 10 mg increments up to a maximum of 80 mg/dayDuration: 24 monthsWhen 6-TGN level reached 450 pmol/8 × 108 RBC, but the patient had not responded, a 5 mg/day increase could be made and the patient was monitored every 2 weeks for efficacy and toxicity or until white blood cell count started to decreaseNo intervention group–5-ASA (n = NR; 5-ASA, 2250–3000 mg/day)Sulphasalazine (n = NR; 3000 mg/day)Duration: 24 months | Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | Diet | Co-intervention | Elemental nutrition group | Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) at ≥ 900 kcal/day, taken via self-inserted feeding tube (2 patients) or by oral intake (32 patients) | 5-ASA (n = NR; 5-ASA, 2250–3000 mg/day) | Restricted diet: patients were allowed an intake of 3.5–4.0 kcal/kg/day from food as recommended by a qualified dietitian | Sulphasalazine (n = NR; 3000 mg/day) | Duration: 24 months | Duration: 24 months | 6-MP group | Starting dose 20 mg/day (weight< 45 kg) | 5-ASA (n = NR; 5-ASA, 2250–3000 mg/day) | Starting dose 30 mg/day (weight ≥ 45 kg) | Sulphasalazine (n = NR; 3000 mg/day) | Within 8–12 weeks of the initial dosing, if 6-TGN level ≤ 200 pmol/8 × 108 RBC, the dose of 6-MP could be increased by 10 mg increments up to a maximum of 80 mg/day | Duration: 24 months | When 6-TGN level reached 450 pmol/8 × 108 RBC, but the patient had not responded, a 5 mg/day increase could be made and the patient was monitored every 2 weeks for efficacy and toxicity or until white blood cell count started to decrease | No intervention group | – | 5-ASA (n = NR; 5-ASA, 2250–3000 mg/day) | Sulphasalazine (n = NR; 3000 mg/day) | Duration: 24 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diet | Co-intervention | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) at ≥ 900 kcal/day, taken via self-inserted feeding tube (2 patients) or by oral intake (32 patients) | 5-ASA (n = NR; 5-ASA, 2250–3000 mg/day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Restricted diet: patients were allowed an intake of 3.5–4.0 kcal/kg/day from food as recommended by a qualified dietitian | Sulphasalazine (n = NR; 3000 mg/day) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: 24 months | Duration: 24 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6-MP group | Starting dose 20 mg/day (weight< 45 kg) | 5-ASA (n = NR; 5-ASA, 2250–3000 mg/day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Starting dose 30 mg/day (weight ≥ 45 kg) | Sulphasalazine (n = NR; 3000 mg/day) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Within 8–12 weeks of the initial dosing, if 6-TGN level ≤ 200 pmol/8 × 108 RBC, the dose of 6-MP could be increased by 10 mg increments up to a maximum of 80 mg/day | Duration: 24 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| When 6-TGN level reached 450 pmol/8 × 108 RBC, but the patient had not responded, a 5 mg/day increase could be made and the patient was monitored every 2 weeks for efficacy and toxicity or until white blood cell count started to decrease | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No intervention group | – | 5-ASA (n = NR; 5-ASA, 2250–3000 mg/day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sulphasalazine (n = NR; 3000 mg/day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patient baseline characteristics | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group6-MP groupNo intervention groupAge (years), mean (SD)30.1 (7.7)32.5 (8.9)29.8 (10.3)Gender (female), n/N (%)10/32 (31.2)7/30 (23.3)8/33 (24.2)Weight (kg), mean (SD)NRNRNRBMI (kg/m2), mean (SD)NRNRNRSmoking, n/N (%)18/32 (56.2)15/30 (50.0)18/33 (54.5)Previous bowel resection, n/N (%)NRNRNRDuration of CD (months), mean (SD)73.2 (69.6)67.2 (80.4)58.8 (75.6)CDAI score (points), mean (SD)103.4 (21.4)93.2 (27.8)89.9 (30.1)Crohn’s Disease Endoscopic Index of Severity, mean (SD)NRNRNRDisease activity other than CDAI (specify)NRNRNRMucosal ulceration, n/N (%)NRNRNROther complications, n/N (%)NRNRNR | Elemental nutrition group | 6-MP group | No intervention group | Age (years), mean (SD) | 30.1 (7.7) | 32.5 (8.9) | 29.8 (10.3) | Gender (female), n/N (%) | 10/32 (31.2) | 7/30 (23.3) | 8/33 (24.2) | Weight (kg), mean (SD) | NR | NR | NR | BMI (kg/m2), mean (SD) | NR | NR | NR | Smoking, n/N (%) | 18/32 (56.2) | 15/30 (50.0) | 18/33 (54.5) | Previous bowel resection, n/N (%) | NR | NR | NR | Duration of CD (months), mean (SD) | 73.2 (69.6) | 67.2 (80.4) | 58.8 (75.6) | CDAI score (points), mean (SD) | 103.4 (21.4) | 93.2 (27.8) | 89.9 (30.1) | Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NR | Disease activity other than CDAI (specify) | NR | NR | NR | Mucosal ulceration, n/N (%) | NR | NR | NR | Other complications, n/N (%) | NR | NR | NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | 6-MP group | No intervention group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Age (years), mean (SD) | 30.1 (7.7) | 32.5 (8.9) | 29.8 (10.3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gender (female), n/N (%) | 10/32 (31.2) | 7/30 (23.3) | 8/33 (24.2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) | NR | NR | NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean (SD) | NR | NR | NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smoking, n/N (%) | 18/32 (56.2) | 15/30 (50.0) | 18/33 (54.5) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous bowel resection, n/N (%) | NR | NR | NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of CD (months), mean (SD) | 73.2 (69.6) | 67.2 (80.4) | 58.8 (75.6) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | 103.4 (21.4) | 93.2 (27.8) | 89.9 (30.1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Disease activity other than CDAI (specify) | NR | NR | NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mucosal ulceration, n/N (%) | NR | NR | NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other complications, n/N (%) | NR | NR | NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Efficacy outcomes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For each timing of assessment please provide a separate table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For scores, extract only total scores | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline follow-up assessment timing (specify): 6, 12, 18, 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group6-MP groupNo intervention groupBetween-group difference, p-value (or 95% CI)aPatients remaining in remission, n/N (%)27/32 (84.4) at 6 months24/30 (80.0) at 6 months23/33 (69.6) at 6 months(1 vs. 2)20/32 (62.5) at 12 months20/30 (66.7) at 12 months15/33 (45.5) at 12 months RR 1.05 (0.83 to 1.33) at 6 months; calculated14/32 (46.9) at 24 months17/30 (56.7) at 24 months7/33 (21.2) at 24 months RR 0.93 (0.64 to 1.35) at 12 months; calculated RR 0.77 (0.46 to 1.27) at 24 months; calculated(1 vs. 3) RR 1.21 (0.92 to 1.58) at 6 months; calculated RR 1.37 (0.86 to 2.17) at 12 months; calculated RR 2.06 (1.00 to 4.43) at 24 months; calculatedDuration of remission (months) [mean (SD) or 95% CI]NRNRNRNARisk of relapse or recurrence, n/N (%)12/32 (37.5) at 24 months7/30 (23.3) at 24 months21/33 (63.6) at 24 months(1 vs. 2) RR 1.61 (0.73 to 3.53) at 24 months; calculated(1 vs. 3) RR 0.58 (0.35 to 0.98) at 24 months; calculatedTime to relapse (months) [mean (SD) or 95% CI]NRNRNRNASurvival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI)NRNRNR(1 vs. 2) p = 0.83 (NS) at 6 months p = 0.54 (NS) at 12 months p = 0.41 (NS) at 18 months p = 0.31 (NS) at 24 months(1 vs. 3) p = 0.19 (NS) at 6 months p = 0.17 (NS) at 12 months p = 0.04 (SS) at 18 months p = 0.03 (SS) at 24 monthsPatients achieving mucosal healing, n/N (%)NRNRNRNACDAI score (points) [mean (SD)]NRNRNRNAThe Short Form Health Survey (SF-36), mean (SD) or 95% CINRNRNRNAThe Short Form Health Survey (SF-12), mean (SD) or 95% CINRNRNRNAThe EQ-5D questionnaire, mean (SD) or 95% CINRNRNRNAOther HRQoL (specify), mean (SD) or 95% CINRNRNRNAWeight (kg), mean (SD) or 95% CINRNRNRNAWeight gain (kg), mean change (SD) or 95% CINRNRNRNABMI (kg/m2), mean change (SD) or 95% CINRNRNRNAHeight gain (cm), mean (SD) or 95% CINRNRNRNALinear growth rate (mean height-for-age z-value)NRNRNRNAAdherence, n/N (%)NRNRNRNANeed for surgery, n/N (%)1/32 (3.1)1/30 (3.1)1/33 (3.0)1 vs. 2 p > 0.99 [NS], Fisher’s exact test; RR 0.93 (0.06 to 14.32) calculated1 vs. 3 p > 0.99 [NS], Fisher’s exact test; RR 1.03 (0.06 to 15.79) calculatedSteroid dose tapering, n/N (%)NRNRNRNAWithdrawal from steroids, n/N (%)NRNRNRNAAdverse events due to treatment, n/N (%)0/32 (0.0)2/30 (6.6) (elevated AST)1/33 (3.0) (elevated amylase)–1/30 (3.1) (hair loss)AST, aspartate transaminase; EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; RBC, red blood cell.a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). | Elemental nutrition group | 6-MP group | No intervention group | Between-group difference, p-value (or 95% CI)a | Patients remaining in remission, n/N (%) | 27/32 (84.4) at 6 months | 24/30 (80.0) at 6 months | 23/33 (69.6) at 6 months | (1 vs. 2) | 20/32 (62.5) at 12 months | 20/30 (66.7) at 12 months | 15/33 (45.5) at 12 months | RR 1.05 (0.83 to 1.33) at 6 months; calculated | 14/32 (46.9) at 24 months | 17/30 (56.7) at 24 months | 7/33 (21.2) at 24 months | RR 0.93 (0.64 to 1.35) at 12 months; calculated | RR 0.77 (0.46 to 1.27) at 24 months; calculated | (1 vs. 3) | RR 1.21 (0.92 to 1.58) at 6 months; calculated | RR 1.37 (0.86 to 2.17) at 12 months; calculated | RR 2.06 (1.00 to 4.43) at 24 months; calculated | Duration of remission (months) [mean (SD) or 95% CI] | NR | NR | NR | NA | Risk of relapse or recurrence, n/N (%) | 12/32 (37.5) at 24 months | 7/30 (23.3) at 24 months | 21/33 (63.6) at 24 months | (1 vs. 2) | RR 1.61 (0.73 to 3.53) at 24 months; calculated | (1 vs. 3) | RR 0.58 (0.35 to 0.98) at 24 months; calculated | Time to relapse (months) [mean (SD) or 95% CI] | NR | NR | NR | NA | Survival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI) | NR | NR | NR | (1 vs. 2) | p = 0.83 (NS) at 6 months | p = 0.54 (NS) at 12 months | p = 0.41 (NS) at 18 months | p = 0.31 (NS) at 24 months | (1 vs. 3) | p = 0.19 (NS) at 6 months | p = 0.17 (NS) at 12 months | p = 0.04 (SS) at 18 months | p = 0.03 (SS) at 24 months | Patients achieving mucosal healing, n/N (%) | NR | NR | NR | NA | CDAI score (points) [mean (SD)] | NR | NR | NR | NA | The Short Form Health Survey (SF-36), mean (SD) or 95% CI | NR | NR | NR | NA | The Short Form Health Survey (SF-12), mean (SD) or 95% CI | NR | NR | NR | NA | The EQ-5D questionnaire, mean (SD) or 95% CI | NR | NR | NR | NA | Other HRQoL (specify), mean (SD) or 95% CI | NR | NR | NR | NA | Weight (kg), mean (SD) or 95% CI | NR | NR | NR | NA | Weight gain (kg), mean change (SD) or 95% CI | NR | NR | NR | NA | BMI (kg/m2), mean change (SD) or 95% CI | NR | NR | NR | NA | Height gain (cm), mean (SD) or 95% CI | NR | NR | NR | NA | Linear growth rate (mean height-for-age z-value) | NR | NR | NR | NA | Adherence, n/N (%) | NR | NR | NR | NA | Need for surgery, n/N (%) | 1/32 (3.1) | 1/30 (3.1) | 1/33 (3.0) | 1 vs. 2 | p > 0.99 [NS], Fisher’s exact test; RR 0.93 (0.06 to 14.32) calculated | 1 vs. 3 | p > 0.99 [NS], Fisher’s exact test; RR 1.03 (0.06 to 15.79) calculated | Steroid dose tapering, n/N (%) | NR | NR | NR | NA | Withdrawal from steroids, n/N (%) | NR | NR | NR | NA | Adverse events due to treatment, n/N (%) | 0/32 (0.0) | 2/30 (6.6) (elevated AST) | 1/33 (3.0) (elevated amylase) | – | 1/30 (3.1) (hair loss) | AST, aspartate transaminase; EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; RBC, red blood cell. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | 6-MP group | No intervention group | Between-group difference, p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients remaining in remission, n/N (%) | 27/32 (84.4) at 6 months | 24/30 (80.0) at 6 months | 23/33 (69.6) at 6 months | (1 vs. 2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 20/32 (62.5) at 12 months | 20/30 (66.7) at 12 months | 15/33 (45.5) at 12 months | RR 1.05 (0.83 to 1.33) at 6 months; calculated | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 14/32 (46.9) at 24 months | 17/30 (56.7) at 24 months | 7/33 (21.2) at 24 months | RR 0.93 (0.64 to 1.35) at 12 months; calculated | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RR 0.77 (0.46 to 1.27) at 24 months; calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (1 vs. 3) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RR 1.21 (0.92 to 1.58) at 6 months; calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RR 1.37 (0.86 to 2.17) at 12 months; calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RR 2.06 (1.00 to 4.43) at 24 months; calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of remission (months) [mean (SD) or 95% CI] | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Risk of relapse or recurrence, n/N (%) | 12/32 (37.5) at 24 months | 7/30 (23.3) at 24 months | 21/33 (63.6) at 24 months | (1 vs. 2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RR 1.61 (0.73 to 3.53) at 24 months; calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (1 vs. 3) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RR 0.58 (0.35 to 0.98) at 24 months; calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Time to relapse (months) [mean (SD) or 95% CI] | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Survival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI) | NR | NR | NR | (1 vs. 2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.83 (NS) at 6 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.54 (NS) at 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.41 (NS) at 18 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.31 (NS) at 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (1 vs. 3) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.19 (NS) at 6 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.17 (NS) at 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.04 (SS) at 18 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.03 (SS) at 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients achieving mucosal healing, n/N (%) | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points) [mean (SD)] | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-36), mean (SD) or 95% CI | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-12), mean (SD) or 95% CI | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The EQ-5D questionnaire, mean (SD) or 95% CI | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other HRQoL (specify), mean (SD) or 95% CI | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) or 95% CI | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight gain (kg), mean change (SD) or 95% CI | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean change (SD) or 95% CI | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Height gain (cm), mean (SD) or 95% CI | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Linear growth rate (mean height-for-age z-value) | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adherence, n/N (%) | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Need for surgery, n/N (%) | 1/32 (3.1) | 1/30 (3.1) | 1/33 (3.0) | 1 vs. 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p > 0.99 [NS], Fisher’s exact test; RR 0.93 (0.06 to 14.32) calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 vs. 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p > 0.99 [NS], Fisher’s exact test; RR 1.03 (0.06 to 15.79) calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Steroid dose tapering, n/N (%) | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Withdrawal from steroids, n/N (%) | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adverse events due to treatment, n/N (%) | 0/32 (0.0) | 2/30 (6.6) (elevated AST) | 1/33 (3.0) (elevated amylase) | – | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1/30 (3.1) (hair loss) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| AST, aspartate transaminase; EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; RBC, red blood cell. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Complications: number (%) of patients with an event (if more than one follow-up, choose and specify the last follow-up) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group6-MP groupNo intervention groupBetween-group difference, p-value (or 95% CI)aImpaired growth, n/N (%)NRNRNRNADelay in pubertal development, n/N (%)NRNRNRNABowel obstructionNRNRNRNAFistulaeNRNRNRNAAbscess0/32 (0.0)1/30 (3.1)0/33 (0.0)–Colon/bowel cancerNRNRNRNAIntestinal infectionNRNRNRNAOthers (specify)NRNRNRNANA, not applicable; NR, not reported.a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). | Elemental nutrition group | 6-MP group | No intervention group | Between-group difference, p-value (or 95% CI)a | Impaired growth, n/N (%) | NR | NR | NR | NA | Delay in pubertal development, n/N (%) | NR | NR | NR | NA | Bowel obstruction | NR | NR | NR | NA | Fistulae | NR | NR | NR | NA | Abscess | 0/32 (0.0) | 1/30 (3.1) | 0/33 (0.0) | – | Colon/bowel cancer | NR | NR | NR | NA | Intestinal infection | NR | NR | NR | NA | Others (specify) | NR | NR | NR | NA | NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | 6-MP group | No intervention group | Between-group difference, p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Impaired growth, n/N (%) | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Delay in pubertal development, n/N (%) | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bowel obstruction | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fistulae | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abscess | 0/32 (0.0) | 1/30 (3.1) | 0/33 (0.0) | – | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Colon/bowel cancer | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intestinal infection | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Others (specify) | NR | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Authors conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition as maintenance therapy in CD patients was as effective as 6-MP. Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) should be useful for long-term maintenance therapy in CD | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reviewer’s conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| At all follow-up points (6, 12 and 24 months), patients on elemental nutrition and 6-MP experienced similar rates of remission maintenance and relapse; at 6 and 12 months of follow-up, the rates for remission maintenance and relapse were not different between the elemental nutrition and the control (no intervention) groups. However, at 24 months of follow-up, the elemental nutrition group had significantly greater remission maintenance rates and reduced risk of relapse than the control (no intervention) group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Tara Gurung
| Study details | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| First author surname year of publication: Takagi 2006,52 Takagi 2009,54 Takagi 200653 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Country: Japan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study design: RCT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study setting (primary care/specialty clinic/other – specify): specialty clinic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of centres: two | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total length of follow-up: 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Funding (government/private/manufacturer/other – specify): no external funding received | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aim of the study | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| To compare relapse rates in patients with inactive CD receiving half elemental nutrition (elemental nutrition + unrestricted diet) vs. no intervention (unrestricted diet) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Participants | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Recruitment dates: December 2002 to June 2005 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients who received induction therapy: 82 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients achieving remission after induction therapy: 56 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients unable to achieve remission after induction therapy: 26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients excluded before start of maintenance therapy (e.g. in relapse, lost to follow-up): 31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients allocated to maintenance treatment: 51 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inclusion criteria: CD patients if they had just undergone induction of remission | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Exclusion criteria: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Characteristics of participants (total study sample) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean (range or SD) age (years): mean range 28.9–30.8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Women [n (%)]: 14/51 (27.4) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Race/ethnicity [n (%)]: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diagnostic criteria for CD: clinically, endoscopically, radiologically and/or histologically (diagnostic criteria as defined by the Ministry of Health, Labour and Welfare of Japan) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean CDAI score (points) (range or SD): mean range 86.4–101.8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD location [n (%)]: small bowel only [15/51 (29.4)], colon only [9/51 (17.6)], small bowel and colon [27/51 (53.0)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Type of induction therapy (e.g. medical, surgical): elemental enteral nutrition 22/51 (43.1) (1800–2100 kcal/day) for 6–8 weeks; total parenteral nutrition 25/51 (49.0) (1500–2100 kcal/day) for 6–8 weeks; oral/i.v. prednisolone 1/51 (2.0) (40 mg/day, then tapered down every 2 weeks by 5–10 mg); 5 mg/kg i.v. infliximab 3/51 (5.9), and/or surgery [5/51 (7.9)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous surgery [n (%)]: 22/51 (43.1) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group: half elemental nutrition (i.e. elemental nutrition + unrestricted diet) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 2 group: free (unrestricted) diet (no intervention) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group: NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Outcomes (study based) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primary outcomes (list): cumulative rate of relapse | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Measure of disease activity (clinical, endoscopic): CDAI score | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of remission (clinical, endoscopic): CDAI score of < 150 points | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of relapse/recurrence (clinical, endoscopic): CDAI score of > 200 points or the need for therapy to induce remission | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of mucosal healing (clinical, endoscopic): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline timings of primary outcome assessment: 6, 12, 18, 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of patients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TotalElemental nutrition groupFree/unrestricted diet group (no intervention)Intervention 3 groupAllocated to treatment512625NAAnalysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one)51 (ITT)2625NALosses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one)116 (non-adherent; discontinuation of elemental nutrition)5 (non-adherent; cross-intervention)NAITT, intention to treat; NA, not applicable; PP, per protocol. | Total | Elemental nutrition group | Free/unrestricted diet group (no intervention) | Intervention 3 group | Allocated to treatment | 51 | 26 | 25 | NA | Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 51 (ITT) | 26 | 25 | NA | Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 11 | 6 (non-adherent; discontinuation of elemental nutrition) | 5 (non-adherent; cross-intervention) | NA | ITT, intention to treat; NA, not applicable; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total | Elemental nutrition group | Free/unrestricted diet group (no intervention) | Intervention 3 group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allocated to treatment | 51 | 26 | 25 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 51 (ITT) | 26 | 25 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 11 | 6 (non-adherent; discontinuation of elemental nutrition) | 5 (non-adherent; cross-intervention) | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ITT, intention to treat; NA, not applicable; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Interventions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration)DietCo-interventionElemental nutrition groupPatients had to take half the amount of their daily allowance of calories by elemental nutrition and the remaining half by usual unrestricted mealsMesalazine 2250–3000 mg/day p.o. [26/26 (100)]Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) through a self-inserted tube and/or by oral intake. Total energy content of 375 kcal 100 g. The dosage was 900–1200 kcal/day (240–320 g as powder, 900–1200 ml as solution in water, 3–4 sachets)Azathioprine 50 mg/day p.o. [2/26 (7.6)]Unrestricted dietDuration: NRFree/unrestricted diet group (no intervention)Unrestricted diet; patients took all nutrients via their usual un-restricted meals. The energy requirements of individual patients were 35–40 kcal/kg IBW/dayMesalazine 2250–3000 mg/day p.o. [25/25 (100)]Azathioprine 50 mg/day p.o. [4/25 (16.0)]Intervention 3 groupNANAIBW, ideal body weight; p.o., per os. | Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | Diet | Co-intervention | Elemental nutrition group | Patients had to take half the amount of their daily allowance of calories by elemental nutrition and the remaining half by usual unrestricted meals | Mesalazine 2250–3000 mg/day p.o. [26/26 (100)] | Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) through a self-inserted tube and/or by oral intake. Total energy content of 375 kcal 100 g. The dosage was 900–1200 kcal/day (240–320 g as powder, 900–1200 ml as solution in water, 3–4 sachets) | Azathioprine 50 mg/day p.o. [2/26 (7.6)] | Unrestricted diet | Duration: NR | Free/unrestricted diet group (no intervention) | Unrestricted diet; patients took all nutrients via their usual un-restricted meals. The energy requirements of individual patients were 35–40 kcal/kg IBW/day | Mesalazine 2250–3000 mg/day p.o. [25/25 (100)] | Azathioprine 50 mg/day p.o. [4/25 (16.0)] | Intervention 3 group | NA | NA | IBW, ideal body weight; p.o., per os. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diet | Co-intervention | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Patients had to take half the amount of their daily allowance of calories by elemental nutrition and the remaining half by usual unrestricted meals | Mesalazine 2250–3000 mg/day p.o. [26/26 (100)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) through a self-inserted tube and/or by oral intake. Total energy content of 375 kcal 100 g. The dosage was 900–1200 kcal/day (240–320 g as powder, 900–1200 ml as solution in water, 3–4 sachets) | Azathioprine 50 mg/day p.o. [2/26 (7.6)] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unrestricted diet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Free/unrestricted diet group (no intervention) | Unrestricted diet; patients took all nutrients via their usual un-restricted meals. The energy requirements of individual patients were 35–40 kcal/kg IBW/day | Mesalazine 2250–3000 mg/day p.o. [25/25 (100)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Azathioprine 50 mg/day p.o. [4/25 (16.0)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IBW, ideal body weight; p.o., per os. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patient baseline characteristics | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupFree/unrestricted diet group (no intervention)Intervention 3 groupAge (years), mean (SD)30.8 (11.1)28.9 (8.1)NAGender (female), n/N (%)6/26 (23.1)8/25 (32.0)NAWeight (kg), mean (SD)NRNRNABMI (kg/m2), mean (SD)20.1 (3.1)20.0 (3.6)NASmoking, n/N (%)NRNRNAPrevious bowel resection, n/N (%)11/26 (42.3)11/25 (44.0)NADuration of CD (months), mean (SD)49.2 (50.4)67.2 (78.0)NACDAI score (points), mean (SD)101.8 (34.1)86.4 (31.3)NACrohn’s Disease Endoscopic Index of Severity, mean (SD)NRNRNADisease activity other than CDAI (specify)NRNRNAMucosal ulceration, n/N (%)Perianal lesions 12/26 (46.1)Perianal lesions 10/25 (40.0)NAOther complications, n/N (%)NRNRNANA, not applicable; NR, not reported. | Elemental nutrition group | Free/unrestricted diet group (no intervention) | Intervention 3 group | Age (years), mean (SD) | 30.8 (11.1) | 28.9 (8.1) | NA | Gender (female), n/N (%) | 6/26 (23.1) | 8/25 (32.0) | NA | Weight (kg), mean (SD) | NR | NR | NA | BMI (kg/m2), mean (SD) | 20.1 (3.1) | 20.0 (3.6) | NA | Smoking, n/N (%) | NR | NR | NA | Previous bowel resection, n/N (%) | 11/26 (42.3) | 11/25 (44.0) | NA | Duration of CD (months), mean (SD) | 49.2 (50.4) | 67.2 (78.0) | NA | CDAI score (points), mean (SD) | 101.8 (34.1) | 86.4 (31.3) | NA | Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | Disease activity other than CDAI (specify) | NR | NR | NA | Mucosal ulceration, n/N (%) | Perianal lesions 12/26 (46.1) | Perianal lesions 10/25 (40.0) | NA | Other complications, n/N (%) | NR | NR | NA | NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Free/unrestricted diet group (no intervention) | Intervention 3 group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Age (years), mean (SD) | 30.8 (11.1) | 28.9 (8.1) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gender (female), n/N (%) | 6/26 (23.1) | 8/25 (32.0) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean (SD) | 20.1 (3.1) | 20.0 (3.6) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smoking, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous bowel resection, n/N (%) | 11/26 (42.3) | 11/25 (44.0) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of CD (months), mean (SD) | 49.2 (50.4) | 67.2 (78.0) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | 101.8 (34.1) | 86.4 (31.3) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Disease activity other than CDAI (specify) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mucosal ulceration, n/N (%) | Perianal lesions 12/26 (46.1) | Perianal lesions 10/25 (40.0) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other complications, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Efficacy outcomes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For each timing of assessment please provide a separate table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For scores, extract only total scores | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline follow-up assessment timing (specify): 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupFree/unrestricted diet group (no intervention)Intervention 3 groupBetween-group difference, p-value (or 95% CI)aPatients remaining in remission, n/N (%)NRNRNANADuration of remission (months), mean (SD) or 95% CINRNRNANARisk of relapse or recurrence, n/N (%)9/26 (34.6)16/25 (64.0)NAHR (adjusted) = 0.40 (0.16 to 0.98) study reported; in favour of elemental nutrition group. RR 0.54 (0.29 to 0.99) calculated; in favour of elemental nutrition groupTime to relapse (months) [mean (SD) or 95% CI]NRNRNANASurvival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI)NRNRNANAPatients achieving mucosal healing, n/N (%)NRNRNANACDAI score (points), mean (SD)NRNRNANAThe Short Form Health Survey (SF-36), mean (SD) or 95% CINRNRNANAThe Short Form Health Survey (SF-12), mean (SD) or 95% CINRNRNANAThe EQ-5D questionnaire, mean (SD) or 95% CINRNRNANAOther HRQoL (IBDQ), mean (SD) or 95% CIAdjusted mean IBDQ score at 13 months, 171.9 (126.4 to 217.3)Adjusted mean IBDQ score at 13 months, 176.7 (142.5 to 211.0)NAAdjusted mean IBDQ score difference at 13 months, p > 0.05 (NS)Weight (kg), mean (SD) or 95% CINRNRNANAWeight gain (kg), mean change (SD) or 95% CINRNRNAp = NR (NS) study reportedBMI (kg/m2), mean change (SD) or 95% CINRNRNANAHeight gain (cm), mean (SD) or 95% CINRNRNANALinear growth rate (mean height-for-age z-value)NRNRNANAAdherence, n/N (%)20/26 (77.0)20/25 (80.0)NARR 0.96 (0.72 to 1.28) calculatedNeed for surgery, n/N (%)NRNRNANASteroid dose tapering, n/N (%)NRNRNANAWithdrawal from steroids, n/N (%)NRNRNANAAdverse events due to treatment, n/N (%)0/26 (0.0)0/25 (0.0)NANAEQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant.a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). | Elemental nutrition group | Free/unrestricted diet group (no intervention) | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | Patients remaining in remission, n/N (%) | NR | NR | NA | NA | Duration of remission (months), mean (SD) or 95% CI | NR | NR | NA | NA | Risk of relapse or recurrence, n/N (%) | 9/26 (34.6) | 16/25 (64.0) | NA | HR (adjusted) = 0.40 (0.16 to 0.98) study reported; in favour of elemental nutrition group. RR 0.54 (0.29 to 0.99) calculated; in favour of elemental nutrition group | Time to relapse (months) [mean (SD) or 95% CI] | NR | NR | NA | NA | Survival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI) | NR | NR | NA | NA | Patients achieving mucosal healing, n/N (%) | NR | NR | NA | NA | CDAI score (points), mean (SD) | NR | NR | NA | NA | The Short Form Health Survey (SF-36), mean (SD) or 95% CI | NR | NR | NA | NA | The Short Form Health Survey (SF-12), mean (SD) or 95% CI | NR | NR | NA | NA | The EQ-5D questionnaire, mean (SD) or 95% CI | NR | NR | NA | NA | Other HRQoL (IBDQ), mean (SD) or 95% CI | Adjusted mean IBDQ score at 13 months, 171.9 (126.4 to 217.3) | Adjusted mean IBDQ score at 13 months, 176.7 (142.5 to 211.0) | NA | Adjusted mean IBDQ score difference at 13 months, p > 0.05 (NS) | Weight (kg), mean (SD) or 95% CI | NR | NR | NA | NA | Weight gain (kg), mean change (SD) or 95% CI | NR | NR | NA | p = NR (NS) study reported | BMI (kg/m2), mean change (SD) or 95% CI | NR | NR | NA | NA | Height gain (cm), mean (SD) or 95% CI | NR | NR | NA | NA | Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | Adherence, n/N (%) | 20/26 (77.0) | 20/25 (80.0) | NA | RR 0.96 (0.72 to 1.28) calculated | Need for surgery, n/N (%) | NR | NR | NA | NA | Steroid dose tapering, n/N (%) | NR | NR | NA | NA | Withdrawal from steroids, n/N (%) | NR | NR | NA | NA | Adverse events due to treatment, n/N (%) | 0/26 (0.0) | 0/25 (0.0) | NA | NA | EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||
| Elemental nutrition group | Free/unrestricted diet group (no intervention) | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients remaining in remission, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of remission (months), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Risk of relapse or recurrence, n/N (%) | 9/26 (34.6) | 16/25 (64.0) | NA | HR (adjusted) = 0.40 (0.16 to 0.98) study reported; in favour of elemental nutrition group. RR 0.54 (0.29 to 0.99) calculated; in favour of elemental nutrition group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Time to relapse (months) [mean (SD) or 95% CI] | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Survival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients achieving mucosal healing, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-36), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-12), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The EQ-5D questionnaire, mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other HRQoL (IBDQ), mean (SD) or 95% CI | Adjusted mean IBDQ score at 13 months, 171.9 (126.4 to 217.3) | Adjusted mean IBDQ score at 13 months, 176.7 (142.5 to 211.0) | NA | Adjusted mean IBDQ score difference at 13 months, p > 0.05 (NS) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight gain (kg), mean change (SD) or 95% CI | NR | NR | NA | p = NR (NS) study reported | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean change (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Height gain (cm), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adherence, n/N (%) | 20/26 (77.0) | 20/25 (80.0) | NA | RR 0.96 (0.72 to 1.28) calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Need for surgery, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Steroid dose tapering, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Withdrawal from steroids, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adverse events due to treatment, n/N (%) | 0/26 (0.0) | 0/25 (0.0) | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cost outcomes (mean per patient monthly in Yen)54 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupFree/unrestricted diet group (no intervention)Intervention 3 groupCrude costs109,160 (95% CI 63,240 to 155,090)68,970 (95% CI 22,140 to 115,800)NRAge-/gender-adjusted costs111,540 (95% CI 66,850 to 156,240)66,490 (95% CI 20,900 to 112,080)NRMultivariate costsa105,860 (95% CI 57,380 to 154,340). About US$880.0072,400 (95% CI 22,810 to 122,000). About US$600.00p > 0.05 (NS)NR, not reported; NS, not statistically significant.a Adjusted for age, gender, duration of disease, site, perianal lesions, previous gut operation, frequency of relapse, administration of azathioprine, inductive therapy (+ surgery), and mean CDAI score at baseline. | Elemental nutrition group | Free/unrestricted diet group (no intervention) | Intervention 3 group | Crude costs | 109,160 (95% CI 63,240 to 155,090) | 68,970 (95% CI 22,140 to 115,800) | NR | Age-/gender-adjusted costs | 111,540 (95% CI 66,850 to 156,240) | 66,490 (95% CI 20,900 to 112,080) | NR | Multivariate costsa | 105,860 (95% CI 57,380 to 154,340). About US$880.00 | 72,400 (95% CI 22,810 to 122,000). About US$600.00 | p > 0.05 (NS) | NR, not reported; NS, not statistically significant. a Adjusted for age, gender, duration of disease, site, perianal lesions, previous gut operation, frequency of relapse, administration of azathioprine, inductive therapy (+ surgery), and mean CDAI score at baseline. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Free/unrestricted diet group (no intervention) | Intervention 3 group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crude costs | 109,160 (95% CI 63,240 to 155,090) | 68,970 (95% CI 22,140 to 115,800) | NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Age-/gender-adjusted costs | 111,540 (95% CI 66,850 to 156,240) | 66,490 (95% CI 20,900 to 112,080) | NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Multivariate costsa | 105,860 (95% CI 57,380 to 154,340). About US$880.00 | 72,400 (95% CI 22,810 to 122,000). About US$600.00 | p > 0.05 (NS) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NR, not reported; NS, not statistically significant. a Adjusted for age, gender, duration of disease, site, perianal lesions, previous gut operation, frequency of relapse, administration of azathioprine, inductive therapy (+ surgery), and mean CDAI score at baseline. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Complications: number (%) of patients with an event (if more than one follow-up, choose and specify the last follow-up) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupFree/unrestricted diet group(no intervention)Intervention 3 groupBetween-group difference, p-value (or 95% CI)aImpaired growth, n/N (%)0/260/25NANADelay in pubertal development, n/N (%)0/260/25NANABowel obstruction0/260/25NANAFistulae0/260/25NANAAbscess0/260/25NANAColon/bowel cancer0/260/25NANAIntestinal infection0/260/25NANAOthers (specify)0/260/25NANANA, not applicable.a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). | Elemental nutrition group | Free/unrestricted diet group(no intervention) | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | Impaired growth, n/N (%) | 0/26 | 0/25 | NA | NA | Delay in pubertal development, n/N (%) | 0/26 | 0/25 | NA | NA | Bowel obstruction | 0/26 | 0/25 | NA | NA | Fistulae | 0/26 | 0/25 | NA | NA | Abscess | 0/26 | 0/25 | NA | NA | Colon/bowel cancer | 0/26 | 0/25 | NA | NA | Intestinal infection | 0/26 | 0/25 | NA | NA | Others (specify) | 0/26 | 0/25 | NA | NA | NA, not applicable. a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Free/unrestricted diet group(no intervention) | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Impaired growth, n/N (%) | 0/26 | 0/25 | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Delay in pubertal development, n/N (%) | 0/26 | 0/25 | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bowel obstruction | 0/26 | 0/25 | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fistulae | 0/26 | 0/25 | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abscess | 0/26 | 0/25 | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Colon/bowel cancer | 0/26 | 0/25 | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intestinal infection | 0/26 | 0/25 | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Others (specify) | 0/26 | 0/25 | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable. a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Authors conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| At 24 months, patients receiving elemental nutrition experienced significantly reduced risk of relapse compared with those on free diet. No differences were detected in QoL or cost of treatment between the two groups | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reviewer’s conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| At 24 months, patients receiving elemental nutrition experienced significantly reduced risk of relapse compared with those on free diet. No differences were detected in QoL or cost of treatment between the two groups; no adverse events; adherence was similar between the treatment groups; trial terminated at 24 months for ethical reasons | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Tara Gurung
| Study details | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| First author surname year of publication: Verma 200155 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Country: UK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study design: RCT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study setting (primary care/specialty clinic/other – specify): specialty clinic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of centres: one | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total length of follow-up: 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Funding (government/private/manufacturer/other – specify): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aim of the study | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| To compare safety and efficacy of elemental and polymeric nutrition in terms of the maintenance of remission, relapse and intolerance | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Participants | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Recruitment dates: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients who received induction therapy: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients achieving remission after induction therapy: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients unable to achieve remission after induction therapy: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients excluded before start of maintenance therapy (e.g. in relapse, lost to follow-up): 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients allocated to maintenance treatment: 33 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inclusion criteria: patients with inactive CD and documented previously steroid dependency for maintaining clinical remission and two previous unsuccessful attempts to withdraw steroid that prompted recurrence during or after 30 days of withdrawal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Exclusion criteria: recurrent small-bowel obstruction due to Crohn strictures, significant sepsis including perianal disease, previous intolerance to enteral feeding or unwilling to give formal written consent | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Characteristics of participants (total study sample) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean (range or SD) age (years): 40.8 (SD 2.7, range 17–76) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Women [n (%)]: 23/33 (70.7) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Race/ethnicity [n (%)]: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diagnostic criteria for CD: standard clinical, radiological, endoscopic and histological criteria | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean CDAI score (points) (range or SD): mean range 90.4–106.4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD location [n (%)]: small bowel [11/33 (33.3)], colon [10/33 (30.3)], mixed sites [10/33 (30.3)], anastomotic [2/33 (6.0)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Type of induction therapy (e.g. medical, surgical): medical [prednisolone; mean dose 7.0 (0.5) mg/day] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous surgery [n (%)]: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group: elemental nutrition [EO28 Extra (Nutricia Ltd, Trowbridge, UK)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 2 group: polymeric nutrition (Fortisip, Nutricia Ltd, Trowbridge, UK) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group: NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Outcomes (study based) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primary outcomes (list): remission maintenance rate, time to relapse | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Measure of disease activity (clinical, endoscopic): clinical (CDAI score) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of remission (clinical, endoscopic): clinical (absence of diarrhoea and abdominal pain, CDAI score of ≤ 150 points in the 2 weeks preceding the study, and ESR < 20 mm/hour) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of relapse/recurrence (clinical, endoscopic): clinical (CDAI score of ≥ 200 points or increased by 100 points from baseline) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of mucosal healing (clinical, endoscopic): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline timings of primary outcome assessment: 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of patients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TotalElemental nutrition groupPolymeric nutrition groupIntervention 3 groupAllocated to treatment331914NAAnalysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one)33 (ITT), 27 (PP)19 (ITT), 13 (PP)14 (ITT), 14 (PP)NALosses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one)660NAITT, intention to treat; NA, not applicable; PP, per protocol. | Total | Elemental nutrition group | Polymeric nutrition group | Intervention 3 group | Allocated to treatment | 33 | 19 | 14 | NA | Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 33 (ITT), 27 (PP) | 19 (ITT), 13 (PP) | 14 (ITT), 14 (PP) | NA | Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 6 | 6 | 0 | NA | ITT, intention to treat; NA, not applicable; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total | Elemental nutrition group | Polymeric nutrition group | Intervention 3 group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allocated to treatment | 33 | 19 | 14 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 33 (ITT), 27 (PP) | 19 (ITT), 13 (PP) | 14 (ITT), 14 (PP) | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 6 | 6 | 0 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ITT, intention to treat; NA, not applicable; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Interventions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration)DietCo-interventionElemental nutrition groupOrally taken (EO28 Extra, Nutricia Ltd, Trowbridge, UK); sachets containing powdered feed mixed with tap water (20 g/100 ml); energy content 76 kcal per 20 g/100 ml; the mean daily intake 730 kcal (range 600–1017)Steroids/prednisolone [n = 19; 6.5 (0.8) mg]Unrestricted normal dietAzathioprine (n = 6; dose: NR)Duration: 12 months5-ASA (n = 3; dose: NR)Duration: 12 monthsPolymeric nutrition groupOrally taken (Fortisip, Nutricia Ltd, Trowbridge, UK); ready-to-drink cartons (200 ml); energy content 150 kcal per 100 ml; the mean daily intake 730 kcal (range 600–1017)Steroids/prednisolone [n = 14; 7.1 (0.9) mg]Unrestricted normal dietAzathioprine (n = 8; dose: NR)Duration: 12 months5-ASA (n = 2; dose: NR)Duration: 12 monthsIntervention 3 groupNANANA, not applicable; NR, not reported. | Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | Diet | Co-intervention | Elemental nutrition group | Orally taken (EO28 Extra, Nutricia Ltd, Trowbridge, UK); sachets containing powdered feed mixed with tap water (20 g/100 ml); energy content 76 kcal per 20 g/100 ml; the mean daily intake 730 kcal (range 600–1017) | Steroids/prednisolone [n = 19; 6.5 (0.8) mg] | Unrestricted normal diet | Azathioprine (n = 6; dose: NR) | Duration: 12 months | 5-ASA (n = 3; dose: NR) | Duration: 12 months | Polymeric nutrition group | Orally taken (Fortisip, Nutricia Ltd, Trowbridge, UK); ready-to-drink cartons (200 ml); energy content 150 kcal per 100 ml; the mean daily intake 730 kcal (range 600–1017) | Steroids/prednisolone [n = 14; 7.1 (0.9) mg] | Unrestricted normal diet | Azathioprine (n = 8; dose: NR) | Duration: 12 months | 5-ASA (n = 2; dose: NR) | Duration: 12 months | Intervention 3 group | NA | NA | NA, not applicable; NR, not reported. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diet | Co-intervention | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Orally taken (EO28 Extra, Nutricia Ltd, Trowbridge, UK); sachets containing powdered feed mixed with tap water (20 g/100 ml); energy content 76 kcal per 20 g/100 ml; the mean daily intake 730 kcal (range 600–1017) | Steroids/prednisolone [n = 19; 6.5 (0.8) mg] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unrestricted normal diet | Azathioprine (n = 6; dose: NR) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: 12 months | 5-ASA (n = 3; dose: NR) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Polymeric nutrition group | Orally taken (Fortisip, Nutricia Ltd, Trowbridge, UK); ready-to-drink cartons (200 ml); energy content 150 kcal per 100 ml; the mean daily intake 730 kcal (range 600–1017) | Steroids/prednisolone [n = 14; 7.1 (0.9) mg] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unrestricted normal diet | Azathioprine (n = 8; dose: NR) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: 12 months | 5-ASA (n = 2; dose: NR) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patient baseline characteristics | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupPolymeric nutrition groupIntervention 3 groupAge (years), mean (SD)41.7 (5.4)44.1 (3.2)NAGender (female), n/N (%)13/19 (68.4)9/14 (64.3)NAWeight (kg), mean (SD)62.4 (3.4)71.4 (7.7)NABMI (kg/m2), mean (SD)21.8 (1.2)24.4 (1.6)NASmoking, n/N (%)NRNRNAPrevious bowel resection, n/N (%)NRNRNADuration of CD (months), mean (SD)154.4 (37.2)123.6 (26.4)NACDAI score (points), mean (SD)106.4 (14.9)90.4 (17.8)NACrohn’s Disease Endoscopic Index of Severity, mean (SD)NRNRNADisease activity other than CDAI (specify)NRNRNAMucosal ulceration, n/N (%)NRNRNAOther complications, n/N (%)NRNRNANA, not applicable; NR, not reported. | Elemental nutrition group | Polymeric nutrition group | Intervention 3 group | Age (years), mean (SD) | 41.7 (5.4) | 44.1 (3.2) | NA | Gender (female), n/N (%) | 13/19 (68.4) | 9/14 (64.3) | NA | Weight (kg), mean (SD) | 62.4 (3.4) | 71.4 (7.7) | NA | BMI (kg/m2), mean (SD) | 21.8 (1.2) | 24.4 (1.6) | NA | Smoking, n/N (%) | NR | NR | NA | Previous bowel resection, n/N (%) | NR | NR | NA | Duration of CD (months), mean (SD) | 154.4 (37.2) | 123.6 (26.4) | NA | CDAI score (points), mean (SD) | 106.4 (14.9) | 90.4 (17.8) | NA | Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | Disease activity other than CDAI (specify) | NR | NR | NA | Mucosal ulceration, n/N (%) | NR | NR | NA | Other complications, n/N (%) | NR | NR | NA | NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Polymeric nutrition group | Intervention 3 group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Age (years), mean (SD) | 41.7 (5.4) | 44.1 (3.2) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gender (female), n/N (%) | 13/19 (68.4) | 9/14 (64.3) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) | 62.4 (3.4) | 71.4 (7.7) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean (SD) | 21.8 (1.2) | 24.4 (1.6) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smoking, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous bowel resection, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of CD (months), mean (SD) | 154.4 (37.2) | 123.6 (26.4) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | 106.4 (14.9) | 90.4 (17.8) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Disease activity other than CDAI (specify) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mucosal ulceration, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other complications, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Efficacy outcomes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For each timing of assessment please provide a separate table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For scores, extract only total scores | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline follow-up assessment timing (specify): 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupPolymeric nutrition groupIntervention 3 groupBetween-group difference, p-value (or 95% CI)aPatients remaining in remission, n/N (%)8/19 (42.1)6/14 (42.8)NAp = NR (NS) study reported. RR 0.98 (0.44 to 2.19) calculatedDuration of remission (months, mean (SD) or 95% CINRNRNANARisk of relapse or recurrence, n/N (%)8/19 (42.1)5/14 (35.7)NAp = NR (NS) study reported. RR 1.18 (0.48 to 2.83) calculatedTime to relapse (months), mean (SD) or 95% CINRNRNANASurvival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI)NRNRNANAPatients achieving mucosal healing, n/N (%)NRNRNANACDAI score (points), mean (SD)NRNRNANAThe Short Form Health Survey (SF-36), mean (SD), 95% CINRNRNANAThe Short Form Health Survey (SF-12), mean (SD), 95% CINRNRNANAThe EQ-5D questionnaire, mean (SD), 95% CINRNRNANAOther HRQoL (specify), mean (SD), 95% CINRNRNANAWeight (kg), mean (SD), 95% CINRNRNANAWeight gain (kg), mean change (SD), 95% CINRNRNANABMI (kg/m2) mean change (SD), 95% CINRNRNANAHeight gain (cm), mean (SD), 95% CINRNRNANALinear growth rate (mean height-for-age z-value)NRNRNANAAdherence, n/N (%)13/19 (68.4)14/14 (100.0)RR 0.68 (0.50 to 0.92) calculated; in favour of polymeric nutrition groupNeed for surgery, n/N (%)NRNRNANASteroid dose tapering, n/N (%)NRNRNANAWithdrawal from steroids, n/N (%)8/19 (42.1)6/14 (42.8)p = NR (NS) study reported. RR 0.98 (0.44 to 2.19) calculatedAdverse events due to treatment, n/N (%)NRNRNANAEQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant.a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). | Elemental nutrition group | Polymeric nutrition group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | Patients remaining in remission, n/N (%) | 8/19 (42.1) | 6/14 (42.8) | NA | p = NR (NS) study reported. RR 0.98 (0.44 to 2.19) calculated | Duration of remission (months, mean (SD) or 95% CI | NR | NR | NA | NA | Risk of relapse or recurrence, n/N (%) | 8/19 (42.1) | 5/14 (35.7) | NA | p = NR (NS) study reported. RR 1.18 (0.48 to 2.83) calculated | Time to relapse (months), mean (SD) or 95% CI | NR | NR | NA | NA | Survival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI) | NR | NR | NA | NA | Patients achieving mucosal healing, n/N (%) | NR | NR | NA | NA | CDAI score (points), mean (SD) | NR | NR | NA | NA | The Short Form Health Survey (SF-36), mean (SD), 95% CI | NR | NR | NA | NA | The Short Form Health Survey (SF-12), mean (SD), 95% CI | NR | NR | NA | NA | The EQ-5D questionnaire, mean (SD), 95% CI | NR | NR | NA | NA | Other HRQoL (specify), mean (SD), 95% CI | NR | NR | NA | NA | Weight (kg), mean (SD), 95% CI | NR | NR | NA | NA | Weight gain (kg), mean change (SD), 95% CI | NR | NR | NA | NA | BMI (kg/m2) mean change (SD), 95% CI | NR | NR | NA | NA | Height gain (cm), mean (SD), 95% CI | NR | NR | NA | NA | Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | Adherence, n/N (%) | 13/19 (68.4) | 14/14 (100.0) | RR 0.68 (0.50 to 0.92) calculated; in favour of polymeric nutrition group | Need for surgery, n/N (%) | NR | NR | NA | NA | Steroid dose tapering, n/N (%) | NR | NR | NA | NA | Withdrawal from steroids, n/N (%) | 8/19 (42.1) | 6/14 (42.8) | p = NR (NS) study reported. RR 0.98 (0.44 to 2.19) calculated | Adverse events due to treatment, n/N (%) | NR | NR | NA | NA | EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||
| Elemental nutrition group | Polymeric nutrition group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients remaining in remission, n/N (%) | 8/19 (42.1) | 6/14 (42.8) | NA | p = NR (NS) study reported. RR 0.98 (0.44 to 2.19) calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of remission (months, mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Risk of relapse or recurrence, n/N (%) | 8/19 (42.1) | 5/14 (35.7) | NA | p = NR (NS) study reported. RR 1.18 (0.48 to 2.83) calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Time to relapse (months), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Survival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients achieving mucosal healing, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-36), mean (SD), 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-12), mean (SD), 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The EQ-5D questionnaire, mean (SD), 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other HRQoL (specify), mean (SD), 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD), 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight gain (kg), mean change (SD), 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2) mean change (SD), 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Height gain (cm), mean (SD), 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adherence, n/N (%) | 13/19 (68.4) | 14/14 (100.0) | RR 0.68 (0.50 to 0.92) calculated; in favour of polymeric nutrition group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Need for surgery, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Steroid dose tapering, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Withdrawal from steroids, n/N (%) | 8/19 (42.1) | 6/14 (42.8) | p = NR (NS) study reported. RR 0.98 (0.44 to 2.19) calculated | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adverse events due to treatment, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Complications: number (%) of patients with an event (if more than one follow-up, choose and specify the last follow-up) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupPolymeric nutrition groupIntervention 3 groupBetween-group difference, p-value (or 95% CI)aImpaired growth, n/N (%)NRNRNANADelay in pubertal development, n/N (%)NRNRNANABowel obstructionNRNRNANAFistulaeNRNRNANAAbscessNRNRNANAColon/bowel cancerNRNRNANAIntestinal infectionNRNRNANAOthers (specify)NRNRNANANA, not applicable; NR, not reported.a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). | Elemental nutrition group | Polymeric nutrition group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | Impaired growth, n/N (%) | NR | NR | NA | NA | Delay in pubertal development, n/N (%) | NR | NR | NA | NA | Bowel obstruction | NR | NR | NA | NA | Fistulae | NR | NR | NA | NA | Abscess | NR | NR | NA | NA | Colon/bowel cancer | NR | NR | NA | NA | Intestinal infection | NR | NR | NA | NA | Others (specify) | NR | NR | NA | NA | NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Polymeric nutrition group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Impaired growth, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Delay in pubertal development, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bowel obstruction | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fistulae | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abscess | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Colon/bowel cancer | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intestinal infection | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Others (specify) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Authors conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The two formulas are similar in maintaining remission rate and risk of relapse or withdrawal from steroids use | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reviewer’s conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The two formulas are similar in maintaining remission rate, risk of relapse or withdrawal from steroids use | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Non-randomised controlled trials
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Tara Gurung
| Study details | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| First author surname year of publication: Hirakawa 199351 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Country: Japan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study design: nRCT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study setting (primary care/specialty clinic/other – specify): primary care | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of centres: one | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total length of follow-up: 48 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Funding (government/private/manufacturer/other – specify): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aim of the study | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| To compare the effects of elemental nutrition alone, combination of elemental nutrition and drugs, drugs alone and no intervention on maintenance of remission in CD patients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Participants | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Recruitment dates: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients who received induction therapy: 84 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients achieving remission after induction therapy: 67 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients unable to achieve remission after induction therapy: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients excluded before start of maintenance therapy (e.g. in relapse, lost to follow-up): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients allocated to maintenance treatment: 61 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inclusion criteria: patients with CD in remission | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Exclusion criteria: patients with active CD | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Characteristics of participants (total study sample) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean (range or SD) age (years): mean 21.9–27.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Women [n (%)]: 14/53 (26.4) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Race/ethnicity [n (%)]: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diagnostic criteria for CD: criteria of the Japanese Society Gastroenterology | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean CDAI score (points) (range or SD): mean 61.6–69.3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD location [n (%)]: small bowel [5/53 (9.4)], large bowel [6/53 (11.3)], small and large bowels [42/53 (79.2)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Type of induction therapy (e.g. medical, surgical): elemental nutrition [25/53 (47.1)], elemental nutrition and drugs [23/53 (43.4)], drugs alone [5/53 (9.4)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous surgery [n (%)]: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group: elemental nutrition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 2 group: elemental nutrition + drugs (sulfasalazine 3 g/day or prednisolone 10 mg/day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group: drugs (sulfasalazine 3 g/day or prednisolone 10 mg/day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 4 group: no intervention | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Outcomes (study based) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primary outcomes (list): cumulative continuous remission rate | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Measure of disease activity (clinical, endoscopic): CDAI and IOIBD scores | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of remission (clinical, endoscopic): IOIBD score (value: NR) and normal values of ESR and CRP | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of relapse/recurrence (clinical, endoscopic): recurrence of subjective/objective symptoms (increase of the IOIBD score by ≥ 2, enhanced ESR and positive CRP) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of mucosal healing (clinical, endoscopic): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline timings of primary outcome assessment: 12, 24, 36 and 48 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of patients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TotalElemental nutrition groupElemental nutrition + drugs groupDrugs groupNo intervention groupAllocated to treatment61252286Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one)(n=53) PP221786Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one)83500ITT, intention to treat; PP, per protocol. | Total | Elemental nutrition group | Elemental nutrition + drugs group | Drugs group | No intervention group | Allocated to treatment | 61 | 25 | 22 | 8 | 6 | Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | (n=53) PP | 22 | 17 | 8 | 6 | Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 8 | 3 | 5 | 0 | 0 | ITT, intention to treat; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total | Elemental nutrition group | Elemental nutrition + drugs group | Drugs group | No intervention group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allocated to treatment | 61 | 25 | 22 | 8 | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | (n=53) PP | 22 | 17 | 8 | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 8 | 3 | 5 | 0 | 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ITT, intention to treat; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Interventions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration)DietCo-interventionElemental nutrition group> 30 kcal/kg IBW/day through nasoenteral tube as home elemental enteral hyperalimentation–Actual consumption: 35.2 (SD = 4.8) kcal/kg IBW/dayBrand: NRDuration: NRRestricted diet additionallyElemental nutrition + drugs group> 30 kcal/kg IBW/day through nasoenteral tube as home elemental enteral hyperalimentationNRActual consumption: 31.8 (SD = 4.4) kcal/kg IBW/dayBrand: NRDuration: NRSulfasalazine 3 g/day (n = 10)Prednisolone 10 mg/day (n = 7)Duration: NRRestricted diet additionallyDrugs groupSulfasalazine 3 g/day (n = 10)NRPrednisolone 10 mg/day (n = 7)Duration: NRRestricted dietNo intervention groupRestricted diet–IBW, ideal body weight; NR, not reported. | Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | Diet | Co-intervention | Elemental nutrition group | > 30 kcal/kg IBW/day through nasoenteral tube as home elemental enteral hyperalimentation | – | Actual consumption: 35.2 (SD = 4.8) kcal/kg IBW/day | Brand: NR | Duration: NR | Restricted diet additionally | Elemental nutrition + drugs group | > 30 kcal/kg IBW/day through nasoenteral tube as home elemental enteral hyperalimentation | NR | Actual consumption: 31.8 (SD = 4.4) kcal/kg IBW/day | Brand: NR | Duration: NR | Sulfasalazine 3 g/day (n = 10) | Prednisolone 10 mg/day (n = 7) | Duration: NR | Restricted diet additionally | Drugs group | Sulfasalazine 3 g/day (n = 10) | NR | Prednisolone 10 mg/day (n = 7) | Duration: NR | Restricted diet | No intervention group | Restricted diet | – | IBW, ideal body weight; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diet | Co-intervention | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | > 30 kcal/kg IBW/day through nasoenteral tube as home elemental enteral hyperalimentation | – | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Actual consumption: 35.2 (SD = 4.8) kcal/kg IBW/day | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brand: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Restricted diet additionally | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition + drugs group | > 30 kcal/kg IBW/day through nasoenteral tube as home elemental enteral hyperalimentation | NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Actual consumption: 31.8 (SD = 4.4) kcal/kg IBW/day | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brand: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sulfasalazine 3 g/day (n = 10) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prednisolone 10 mg/day (n = 7) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Restricted diet additionally | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Drugs group | Sulfasalazine 3 g/day (n = 10) | NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prednisolone 10 mg/day (n = 7) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Restricted diet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No intervention group | Restricted diet | – | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IBW, ideal body weight; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patient baseline characteristics | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupElemental nutrition + drugs groupDrugs groupNo intervention groupAge (years), mean (SD)27.0 (7.4)26.6 (2.4)21.9 (2.6)25.7 (5.0)Gender (female), n/N (%)3/22 (13.6)6/17 (35.3)3/8 (37.5)2/6 (33.3)Weight (kg), mean (SD)NRNRNRNRBMI (kg/m2), mean (SD)NRNRNRNRSmoking, n/N (%)NRNRNRNRPrevious bowel resection, n/N (%)NRNRNRNRDuration of CD (months), mean (SD)NRNRNRNRCDAI score (points), mean (SD)61.6 (29.2)56.0 (26.6)68.5 (30.2)69.3 (52.1)Crohn’s Disease Endoscopic Index of Severity, mean (SD)NRNRNRNRDisease activity other than CDAI (IOIBD)0.2 (0.5)0.3 (0.5)0.3 (0.5)0.3 (0.5)Mucosal ulceration, n/N (%)NRNRNRNROther complications, n/N (%)Fistula 8/22 (36.4)Fistula 9/17 (53.0)Fistula 3/8 (37.5)Fistula 1/6 (16.6)NR, not reported. | Elemental nutrition group | Elemental nutrition + drugs group | Drugs group | No intervention group | Age (years), mean (SD) | 27.0 (7.4) | 26.6 (2.4) | 21.9 (2.6) | 25.7 (5.0) | Gender (female), n/N (%) | 3/22 (13.6) | 6/17 (35.3) | 3/8 (37.5) | 2/6 (33.3) | Weight (kg), mean (SD) | NR | NR | NR | NR | BMI (kg/m2), mean (SD) | NR | NR | NR | NR | Smoking, n/N (%) | NR | NR | NR | NR | Previous bowel resection, n/N (%) | NR | NR | NR | NR | Duration of CD (months), mean (SD) | NR | NR | NR | NR | CDAI score (points), mean (SD) | 61.6 (29.2) | 56.0 (26.6) | 68.5 (30.2) | 69.3 (52.1) | Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NR | NR | Disease activity other than CDAI (IOIBD) | 0.2 (0.5) | 0.3 (0.5) | 0.3 (0.5) | 0.3 (0.5) | Mucosal ulceration, n/N (%) | NR | NR | NR | NR | Other complications, n/N (%) | Fistula 8/22 (36.4) | Fistula 9/17 (53.0) | Fistula 3/8 (37.5) | Fistula 1/6 (16.6) | NR, not reported. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Elemental nutrition + drugs group | Drugs group | No intervention group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Age (years), mean (SD) | 27.0 (7.4) | 26.6 (2.4) | 21.9 (2.6) | 25.7 (5.0) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gender (female), n/N (%) | 3/22 (13.6) | 6/17 (35.3) | 3/8 (37.5) | 2/6 (33.3) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) | NR | NR | NR | NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean (SD) | NR | NR | NR | NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smoking, n/N (%) | NR | NR | NR | NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous bowel resection, n/N (%) | NR | NR | NR | NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of CD (months), mean (SD) | NR | NR | NR | NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | 61.6 (29.2) | 56.0 (26.6) | 68.5 (30.2) | 69.3 (52.1) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NR | NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Disease activity other than CDAI (IOIBD) | 0.2 (0.5) | 0.3 (0.5) | 0.3 (0.5) | 0.3 (0.5) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mucosal ulceration, n/N (%) | NR | NR | NR | NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other complications, n/N (%) | Fistula 8/22 (36.4) | Fistula 9/17 (53.0) | Fistula 3/8 (37.5) | Fistula 1/6 (16.6) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Efficacy outcomes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For each timing of assessment please provide a separate table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For scores, extract only total scores | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline follow-up assessment timing (specify): 12, 24 and 48 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupElemental nutrition + drugs groupDrugs groupNo intervention groupBetween-group difference, p-value (or 95% CI)aPatients remaining in remission, n/N (%)NRNRNRNRNADuration of remission (months), mean (SD) or 95% CINRNRNRNRNARisk of relapse or recurrence n/N (%)NRNRNRNRNATime to relapse (months), mean (SD) or 95% CINRNRNRNRNASurvival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI)12 months: 94% (NR)75% (NR)63% (NR)50% (NR)At 48 months24 months: 63% (NR)66% (NR)42% (NR)33% (NR)p < 0.05 (1 vs. 3), SS48 months: 63% (NR)66% (NR)0% (NR)0% (NR)p < 0.01 (1 vs. 4), SSp < 0.05 (2 vs. 4), SSp ≥ 0.05 (2 vs. 3), NSp ≥ 0.05 (1 vs. 2), NSPatients achieving mucosal healing, n/N (%)NRNRNRNRNACDAI score (points), mean (SD)NRNRNRNRNAThe Short Form Health Survey (SF-36), [mean (SD) 95% CI]NRNRNRNRNAThe Short Form Health Survey (SF-12), mean (SD) 95% CINRNRNRNRNAThe EQ-5D, mean (SD) 95% CINRNRNRNRNAOther HRQoL (specify), mean (SD) 95% CINRNRNRNRNAWeight (kg), mean (SD) 95% CINRNRNRNRNAWeight gain (kg), mean change (SD) 95% CINRNRNRNRNABMI (kg/m2), mean change (SD) 95% CINRNRNRNRNAHeight gain (cm), mean (SD) 95% CINRNRNRNRNALinear growth rate (mean height-for-age z-value)NRNRNRNRNAAdherence, n/N (%)22/25 (88.0)17/22 (77.3)8/8 (100.0)6/6 (100.0)Fisher’s exact testp = 0.55 (1 vs. 2), NSp = 0.84 (1 vs. 3), NSp > 0.99 (1 vs. 4), NSp = 0.37 (2 vs. 3), NSp = 0.53 (2 vs. 4), NSCalculatedNeed for surgery, n/N (%)NRNRNRNRNASteroid dose tapering, n/N (%)NRNRNRNRNAWithdrawal from steroids, n/N (%)NRNRNRNRNAAdverse events due to treatment, n/N (%)NRNRNRNRNAEQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported, NS, not statistically significant; SS, statistically significant.a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). | Elemental nutrition group | Elemental nutrition + drugs group | Drugs group | No intervention group | Between-group difference, p-value (or 95% CI)a | Patients remaining in remission, n/N (%) | NR | NR | NR | NR | NA | Duration of remission (months), mean (SD) or 95% CI | NR | NR | NR | NR | NA | Risk of relapse or recurrence n/N (%) | NR | NR | NR | NR | NA | Time to relapse (months), mean (SD) or 95% CI | NR | NR | NR | NR | NA | Survival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI) | 12 months: 94% (NR) | 75% (NR) | 63% (NR) | 50% (NR) | At 48 months | 24 months: 63% (NR) | 66% (NR) | 42% (NR) | 33% (NR) | p < 0.05 (1 vs. 3), SS | 48 months: 63% (NR) | 66% (NR) | 0% (NR) | 0% (NR) | p < 0.01 (1 vs. 4), SS | p < 0.05 (2 vs. 4), SS | p ≥ 0.05 (2 vs. 3), NS | p ≥ 0.05 (1 vs. 2), NS | Patients achieving mucosal healing, n/N (%) | NR | NR | NR | NR | NA | CDAI score (points), mean (SD) | NR | NR | NR | NR | NA | The Short Form Health Survey (SF-36), [mean (SD) 95% CI] | NR | NR | NR | NR | NA | The Short Form Health Survey (SF-12), mean (SD) 95% CI | NR | NR | NR | NR | NA | The EQ-5D, mean (SD) 95% CI | NR | NR | NR | NR | NA | Other HRQoL (specify), mean (SD) 95% CI | NR | NR | NR | NR | NA | Weight (kg), mean (SD) 95% CI | NR | NR | NR | NR | NA | Weight gain (kg), mean change (SD) 95% CI | NR | NR | NR | NR | NA | BMI (kg/m2), mean change (SD) 95% CI | NR | NR | NR | NR | NA | Height gain (cm), mean (SD) 95% CI | NR | NR | NR | NR | NA | Linear growth rate (mean height-for-age z-value) | NR | NR | NR | NR | NA | Adherence, n/N (%) | 22/25 (88.0) | 17/22 (77.3) | 8/8 (100.0) | 6/6 (100.0) | Fisher’s exact test | p = 0.55 (1 vs. 2), NS | p = 0.84 (1 vs. 3), NS | p > 0.99 (1 vs. 4), NS | p = 0.37 (2 vs. 3), NS | p = 0.53 (2 vs. 4), NS | Calculated | Need for surgery, n/N (%) | NR | NR | NR | NR | NA | Steroid dose tapering, n/N (%) | NR | NR | NR | NR | NA | Withdrawal from steroids, n/N (%) | NR | NR | NR | NR | NA | Adverse events due to treatment, n/N (%) | NR | NR | NR | NR | NA | EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported, NS, not statistically significant; SS, statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Elemental nutrition + drugs group | Drugs group | No intervention group | Between-group difference, p-value (or 95% CI)a | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients remaining in remission, n/N (%) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of remission (months), mean (SD) or 95% CI | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Risk of relapse or recurrence n/N (%) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Time to relapse (months), mean (SD) or 95% CI | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Survival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI) | 12 months: 94% (NR) | 75% (NR) | 63% (NR) | 50% (NR) | At 48 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 24 months: 63% (NR) | 66% (NR) | 42% (NR) | 33% (NR) | p < 0.05 (1 vs. 3), SS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 48 months: 63% (NR) | 66% (NR) | 0% (NR) | 0% (NR) | p < 0.01 (1 vs. 4), SS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p < 0.05 (2 vs. 4), SS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p ≥ 0.05 (2 vs. 3), NS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p ≥ 0.05 (1 vs. 2), NS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients achieving mucosal healing, n/N (%) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-36), [mean (SD) 95% CI] | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-12), mean (SD) 95% CI | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The EQ-5D, mean (SD) 95% CI | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other HRQoL (specify), mean (SD) 95% CI | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) 95% CI | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight gain (kg), mean change (SD) 95% CI | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean change (SD) 95% CI | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Height gain (cm), mean (SD) 95% CI | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Linear growth rate (mean height-for-age z-value) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adherence, n/N (%) | 22/25 (88.0) | 17/22 (77.3) | 8/8 (100.0) | 6/6 (100.0) | Fisher’s exact test | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.55 (1 vs. 2), NS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.84 (1 vs. 3), NS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p > 0.99 (1 vs. 4), NS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.37 (2 vs. 3), NS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.53 (2 vs. 4), NS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Need for surgery, n/N (%) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Steroid dose tapering, n/N (%) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Withdrawal from steroids, n/N (%) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adverse events due to treatment, n/N (%) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported, NS, not statistically significant; SS, statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Complications: number (%) of patients with an event (if more than one follow-up, choose and specify the last follow-up) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupElemental nutrition + drugs groupDrugs groupNo intervention groupBetween-group difference, p-value (or 95% CI)aImpaired growth, n/N (%)NRNRNRNRNADelay in pubertal development, n/N (%)NRNRNRNRNABowel obstructionNRNRNRNRNAFistulaeNRNRNRNRNAAbscessNRNRNRNRNAColon/bowel cancerNRNRNRNRNAIntestinal infectionNRNRNRNRNAOthers (specify)NRNRNRNRNANA, not applicable; NR, not reported.a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). | Elemental nutrition group | Elemental nutrition + drugs group | Drugs group | No intervention group | Between-group difference, p-value (or 95% CI)a | Impaired growth, n/N (%) | NR | NR | NR | NR | NA | Delay in pubertal development, n/N (%) | NR | NR | NR | NR | NA | Bowel obstruction | NR | NR | NR | NR | NA | Fistulae | NR | NR | NR | NR | NA | Abscess | NR | NR | NR | NR | NA | Colon/bowel cancer | NR | NR | NR | NR | NA | Intestinal infection | NR | NR | NR | NR | NA | Others (specify) | NR | NR | NR | NR | NA | NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Elemental nutrition + drugs group | Drugs group | No intervention group | Between-group difference, p-value (or 95% CI)a | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Impaired growth, n/N (%) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Delay in pubertal development, n/N (%) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bowel obstruction | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fistulae | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abscess | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Colon/bowel cancer | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intestinal infection | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Others (specify) | NR | NR | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Authors conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| At 1, 2 and 4 years of follow-up, both groups of elemental nutrition (with/without drugs) experienced significantly greater rates of remission maintenance than no intervention; elemental nutrition alone (but not elemental nutrition + drug) was more effective than drug alone | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reviewer’s conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Long-term administration of elemental nutrition with or without drugs in patients with CD resulted in improved rates of maintenance of remission compared with no intervention; there was no significant difference in rates of remission maintenance between the two elemental nutrition or two drug groups | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Tara Gurung
| Study details | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| First author surname and year of publication: Verma 200056 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Country: UK | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study design: nRCT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study setting (primary care/specialty clinic/other – specify): specialty clinic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of centres: one | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total length of follow-up: 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Funding (government/private/manufacturer/other – specify): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aim of the study | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| To evaluate clinical effectiveness of adding an elemental nutrition taken orally to normal food for maintaining remission in patients with quiescent CD over 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Participants | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Recruitment dates: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients who received induction therapy: 46 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients achieving remission after induction therapy: 39 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients unable to achieve remission after induction therapy: 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients excluded before start of maintenance therapy (e.g. in relapse, lost to follow-up): 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients allocated to maintenance treatment: 39 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inclusion criteria: patients with quiescent disease defined by the absence of bowel symptoms and CDAI score of < 150 points who had been treated with either elemental nutrition or prednisolone as an induction therapy within preceding 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Exclusion criteria: CDAI score of > 150 points, sepsis, bowel strictures leading to recurrent attacks of small bowel obstruction or previous intolerance to enteral feeding | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Characteristics of participants (total study sample) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean (range or SD) age (years): mean 39.2–42.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Women [n (%)]: 27 (69.2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Race/ethnicity [n (%)]: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diagnostic criteria for CD: standard clinical, endoscopic, radiological and, when possible, histological criteria | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean CDAI score (points) (range or SD): mean 94.6–112.8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD location [n (%)]: small bowel [17 (43.6)], large bowel [n = 10 (25.6)], mixed [n = 9 (23.0)], anastomotic [n = 3 (7.6)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Type of induction therapy (e.g. medical, surgical): medical (prednisolone, azathioprine, 5-ASA) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous surgery [n (%)]: 12 (100) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group: elemental nutrition ‘EO28 Extra’ (Nutricia Ltd, Trowbridge, UK) (with normal unrestricted diet) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 2 group: no intervention (i.e. normal unrestricted diet) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group: NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Outcomes (study based) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primary outcomes (list): maintenance of clinical remission at 12 months, withdrawal from steroids and duration of remission at 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Measure of disease activity (clinical, endoscopic): CDAI score | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of remission (clinical, endoscopic): CDAI score of < 150 points | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of relapse/recurrence (clinical, endoscopic): increase in CDAI score by > 100 points since baseline or final CDAI score of > 150 points; need of surgery; increased doses of steroids | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of mucosal healing (clinical, endoscopic): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline timings of primary outcome assessment: 1, 3, 6, 9, 12 and 24 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of patients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TotalElemental nutrition groupNo intervention groupIntervention 3 groupAllocated to treatment392118NAAnalysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one)3517 (PP), 21 (ITT)18NALosses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one)40NAITT, intention to treat; NA, not applicable; PP, per protocol. | Total | Elemental nutrition group | No intervention group | Intervention 3 group | Allocated to treatment | 39 | 21 | 18 | NA | Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 35 | 17 (PP), 21 (ITT) | 18 | NA | Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 4 | 0 | NA | ITT, intention to treat; NA, not applicable; PP, per protocol. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total | Elemental nutrition group | No intervention group | Intervention 3 group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allocated to treatment | 39 | 21 | 18 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 35 | 17 (PP), 21 (ITT) | 18 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 4 | 0 | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ITT, intention to treat; NA, not applicable; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Interventions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration)DietCo-interventionElemental nutrition groupEO28 Extra (Nutricia Ltd, Trowbridge, UK) powder containing 443 kcal energy, mixed with water and taken orally in three separate portions daily; mean intake (768.5, SD 50.6 kcal/day)Prednisolone (mean range: 10.5–17.5 mg/day) azathioprine (dose: NR)Duration: 12 months5-ASA (dose: NR)In addition to normal dietDuration: 12 monthsIntervention 2 groupNo intervention (i.e. normal diet)Prednisolone (mean: 13.4 mg/day) azathioprine (dose: NR)Duration: 12 months5-ASA (dose: NR)Duration: 12 monthsIntervention 3 groupNANANA, not applicable; NR, not reported. | Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | Diet | Co-intervention | Elemental nutrition group | EO28 Extra (Nutricia Ltd, Trowbridge, UK) powder containing 443 kcal energy, mixed with water and taken orally in three separate portions daily; mean intake (768.5, SD 50.6 kcal/day) | Prednisolone (mean range: 10.5–17.5 mg/day) azathioprine (dose: NR) | Duration: 12 months | 5-ASA (dose: NR) | In addition to normal diet | Duration: 12 months | Intervention 2 group | No intervention (i.e. normal diet) | Prednisolone (mean: 13.4 mg/day) azathioprine (dose: NR) | Duration: 12 months | 5-ASA (dose: NR) | Duration: 12 months | Intervention 3 group | NA | NA | NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diet | Co-intervention | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | EO28 Extra (Nutricia Ltd, Trowbridge, UK) powder containing 443 kcal energy, mixed with water and taken orally in three separate portions daily; mean intake (768.5, SD 50.6 kcal/day) | Prednisolone (mean range: 10.5–17.5 mg/day) azathioprine (dose: NR) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: 12 months | 5-ASA (dose: NR) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| In addition to normal diet | Duration: 12 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 2 group | No intervention (i.e. normal diet) | Prednisolone (mean: 13.4 mg/day) azathioprine (dose: NR) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: 12 months | 5-ASA (dose: NR) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patient baseline characteristics | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupNo intervention group (i.e. normal diet)Intervention 3 groupAge (years), mean (SD)39.2 (3.9)42.0 (3.3)NAGender (female), n/N (%)14/21 (66.6)13/18 (72.2)NAWeight (kg), mean (SD)59.4 (2.9)62.7 (2.8)NABMI (kg/m2), mean (SD)20.0 (2.2)22.9 (0.9)NASmoking, n/N (%)NRNRNAPrevious bowel resection, n/N (%)NRNRNADuration of CD (months), mean (SD)60.3 (18.4)91.0 (14.8)NACDAI score (points), mean (SD)112.8 (11.5)94.6 (7.1)NACrohn’s Disease Endoscopic Index of Severity, mean (SD)NRNRNADisease activity other than CDAI (specify)NRNRNAMucosal ulceration, n/N (%)NRNRNAOther complications, n/N (%)NRNRNANA, not applicable; NR, not reported. | Elemental nutrition group | No intervention group (i.e. normal diet) | Intervention 3 group | Age (years), mean (SD) | 39.2 (3.9) | 42.0 (3.3) | NA | Gender (female), n/N (%) | 14/21 (66.6) | 13/18 (72.2) | NA | Weight (kg), mean (SD) | 59.4 (2.9) | 62.7 (2.8) | NA | BMI (kg/m2), mean (SD) | 20.0 (2.2) | 22.9 (0.9) | NA | Smoking, n/N (%) | NR | NR | NA | Previous bowel resection, n/N (%) | NR | NR | NA | Duration of CD (months), mean (SD) | 60.3 (18.4) | 91.0 (14.8) | NA | CDAI score (points), mean (SD) | 112.8 (11.5) | 94.6 (7.1) | NA | Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | Disease activity other than CDAI (specify) | NR | NR | NA | Mucosal ulceration, n/N (%) | NR | NR | NA | Other complications, n/N (%) | NR | NR | NA | NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | No intervention group (i.e. normal diet) | Intervention 3 group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Age (years), mean (SD) | 39.2 (3.9) | 42.0 (3.3) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gender (female), n/N (%) | 14/21 (66.6) | 13/18 (72.2) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) | 59.4 (2.9) | 62.7 (2.8) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean (SD) | 20.0 (2.2) | 22.9 (0.9) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smoking, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous bowel resection, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of CD (months), mean (SD) | 60.3 (18.4) | 91.0 (14.8) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | 112.8 (11.5) | 94.6 (7.1) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Disease activity other than CDAI (specify) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mucosal ulceration, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other complications, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Efficacy outcomes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For each timing of assessment please provide a separate table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For scores, extract only total scores | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline follow-up assessment timing (specify): 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupNo intervention group (i.e. normal diet)Intervention 3 groupBetween-group difference, p-value (or 95% CI)aPatients remaining in remission, n/N (%)10/21 (47.6)4/18 (22.2)NAp = 0.0003 (SS). RR 2.14 (0.81 to 5.67), p = 0.18 (NS) calculatedDuration of remission (months), mean (SD) or 95% CINRNRNANARisk of relapse or recurrence, n/N (%)7/21 (33.3)14/18 (77.7)NAp < 0.00001 (SS). RR 0.50 (0.25 to 0.98) calculatedTime to relapse (months), mean (SD) or 95% CI7.4 (0.9)6.2 (0.4)NANR (study report). MD = 1.2 (0.35 to 2.04), p = 0.012 (SS) calculatedSurvival rate (% patients in remission who have not relapsed), Kaplan–Meier estimate and 95% CINRNRNANAPatients achieving mucosal healing, n/N (%)NRNRNANACDAI score (points), mean (SD)NRNRNANAThe Short Form Health Survey (SF-36), mean (SD) or 95% CINRNRNANAThe Short Form Health Survey (SF-12), mean (SD) or 95% CINRNRNANAThe EQ-5D questionnaire, mean (SD) or 95% CINRNRNANAOther HRQoL (specify), mean (SD) or 95% CINRNRNANAWeight (kg), mean (SD) or 95% CINRNRNANAWeight gain (kg), mean change (SD) or 95% CINRNRNANABMI (kg/m2), mean change (SD) or 95% CINRNRNANAHeight gain (cm), mean (SD) or 95% CINRNRNANALinear growth rate (mean height-for-age z-value)NRNRNANAAdherence, n/N (%)17/21 (80.9)18/18 (100.0)NANR (study report), RR 0.81 (0.65 to 0.99) calculated; in favour of no intervention groupNeed for surgery, n/N (%)NRNRNANASteroid dose tapering, n/N (%)10/21 (47.6)4/18 (22.2)NANR (study report), RR 2.14 (0.80 to 5.67) (NS) calculatedWithdrawal from steroids, n/N (%)4/21 (19.0)0/18 (0.0)NANRAdverse events due to treatment, n/N (%)NRNRNANAEQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; SS, statistically significant.a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). | Elemental nutrition group | No intervention group (i.e. normal diet) | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | Patients remaining in remission, n/N (%) | 10/21 (47.6) | 4/18 (22.2) | NA | p = 0.0003 (SS). RR 2.14 (0.81 to 5.67), p = 0.18 (NS) calculated | Duration of remission (months), mean (SD) or 95% CI | NR | NR | NA | NA | Risk of relapse or recurrence, n/N (%) | 7/21 (33.3) | 14/18 (77.7) | NA | p < 0.00001 (SS). RR 0.50 (0.25 to 0.98) calculated | Time to relapse (months), mean (SD) or 95% CI | 7.4 (0.9) | 6.2 (0.4) | NA | NR (study report). MD = 1.2 (0.35 to 2.04), p = 0.012 (SS) calculated | Survival rate (% patients in remission who have not relapsed), Kaplan–Meier estimate and 95% CI | NR | NR | NA | NA | Patients achieving mucosal healing, n/N (%) | NR | NR | NA | NA | CDAI score (points), mean (SD) | NR | NR | NA | NA | The Short Form Health Survey (SF-36), mean (SD) or 95% CI | NR | NR | NA | NA | The Short Form Health Survey (SF-12), mean (SD) or 95% CI | NR | NR | NA | NA | The EQ-5D questionnaire, mean (SD) or 95% CI | NR | NR | NA | NA | Other HRQoL (specify), mean (SD) or 95% CI | NR | NR | NA | NA | Weight (kg), mean (SD) or 95% CI | NR | NR | NA | NA | Weight gain (kg), mean change (SD) or 95% CI | NR | NR | NA | NA | BMI (kg/m2), mean change (SD) or 95% CI | NR | NR | NA | NA | Height gain (cm), mean (SD) or 95% CI | NR | NR | NA | NA | Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | Adherence, n/N (%) | 17/21 (80.9) | 18/18 (100.0) | NA | NR (study report), RR 0.81 (0.65 to 0.99) calculated; in favour of no intervention group | Need for surgery, n/N (%) | NR | NR | NA | NA | Steroid dose tapering, n/N (%) | 10/21 (47.6) | 4/18 (22.2) | NA | NR (study report), RR 2.14 (0.80 to 5.67) (NS) calculated | Withdrawal from steroids, n/N (%) | 4/21 (19.0) | 0/18 (0.0) | NA | NR | Adverse events due to treatment, n/N (%) | NR | NR | NA | NA | EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; SS, statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||
| Elemental nutrition group | No intervention group (i.e. normal diet) | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients remaining in remission, n/N (%) | 10/21 (47.6) | 4/18 (22.2) | NA | p = 0.0003 (SS). RR 2.14 (0.81 to 5.67), p = 0.18 (NS) calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of remission (months), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Risk of relapse or recurrence, n/N (%) | 7/21 (33.3) | 14/18 (77.7) | NA | p < 0.00001 (SS). RR 0.50 (0.25 to 0.98) calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Time to relapse (months), mean (SD) or 95% CI | 7.4 (0.9) | 6.2 (0.4) | NA | NR (study report). MD = 1.2 (0.35 to 2.04), p = 0.012 (SS) calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Survival rate (% patients in remission who have not relapsed), Kaplan–Meier estimate and 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients achieving mucosal healing, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-36), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-12), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The EQ-5D questionnaire, mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other HRQoL (specify), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight gain (kg), mean change (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean change (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Height gain (cm), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adherence, n/N (%) | 17/21 (80.9) | 18/18 (100.0) | NA | NR (study report), RR 0.81 (0.65 to 0.99) calculated; in favour of no intervention group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Need for surgery, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Steroid dose tapering, n/N (%) | 10/21 (47.6) | 4/18 (22.2) | NA | NR (study report), RR 2.14 (0.80 to 5.67) (NS) calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Withdrawal from steroids, n/N (%) | 4/21 (19.0) | 0/18 (0.0) | NA | NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adverse events due to treatment, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; SS, statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Complications: number (%) of patients with an event (if more than one follow-up, choose and specify the last follow-up) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupNo intervention groupIntervention 3 groupBetween-group difference, p-value (or 95% CI)aImpaired growth, n/N (%)NRNRNANADelay in pubertal development, n/N (%)NRNRNANABowel obstructionNRNRNANAFistulaeNRNRNANAAbscessNRNRNANAColon/bowel cancerNRNRNANAIntestinal infectionNRNRNANAOthers (specify)NRNRNANANA, not applicable; NR, not reported.a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). | Elemental nutrition group | No intervention group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | Impaired growth, n/N (%) | NR | NR | NA | NA | Delay in pubertal development, n/N (%) | NR | NR | NA | NA | Bowel obstruction | NR | NR | NA | NA | Fistulae | NR | NR | NA | NA | Abscess | NR | NR | NA | NA | Colon/bowel cancer | NR | NR | NA | NA | Intestinal infection | NR | NR | NA | NA | Others (specify) | NR | NR | NA | NA | NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | No intervention group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Impaired growth, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Delay in pubertal development, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bowel obstruction | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fistulae | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abscess | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Colon/bowel cancer | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intestinal infection | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Others (specify) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Authors conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Over 12 months, the EN group had higher maintenance remission rate vs. no intervention (usual diet) group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reviewer’s conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients receiving EN experienced greater remission rates, longer time to relapse, reduced rates of replace, but similar CDAI score, BMI or weight as the control group at 12 months of follow-up; results for steroid tapering/withdrawals, adherence and intolerance are inconclusive owing to small sample number of events or sample size | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Tara Gurung
| Study details | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| First author surname year of publication: Yamamoto 2007,28 Yamamoto 2013,59 Yamamoto 2013,60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Country: Japan | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study design: nRCT | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study setting (primary care/specialty clinic/other – specify): specialty clinic | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of centres: one | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total length of follow-up: 12 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Funding (government/private/manufacturer/other – specify): other (no external funding received) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aim of the study | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| To examine if long-term elemental nutrition infusion along with low-fat diet is useful in reducing clinical and endoscopic recurrence rates after resection for CD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Participants | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Recruitment dates: NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients who received induction therapy: NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients achieving remission after induction therapy: NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients unable to achieve remission after induction therapy: NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients excluded before start of maintenance therapy (e.g. in relapse, lost to follow-up): NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients allocated to maintenance treatment: 40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inclusion criteria: patients with endoscopic and histological diagnosis of CD, aged 15–75 years who had resection for ileal and ileocolonic (including ileocaecal) CD; patients who had received enteral nutrition including elemental nutrition infusion at least once before operation; agreed to continue assigned treatment (with or without enteral nutrition) for more than 1 year after operation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Exclusion criteria: patients with colonic CD alone or with diffuse small bowel CD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Characteristics of participants (total study sample) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean (range or SD) age (years): 32.0 (17.0) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Women [n (%)]: 14/40 (35.0) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Race/ethnicity [n (%)]: NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diagnostic criteria for CD: endoscopic and histological (no specific criteria reported) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean CDAI score (points) (range or SD): NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD location [n (%)]: terminal ileum [12/40 (30.0)], terminal ileum and colon [20/40 (50.0)], ileocolonic anastomosis [8/40 (20.0)] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Type of induction therapy (e.g. medical, surgical): bowel resection [40/40 (100.0)], corticosteroids [37/40 (92.5)], Pentasa [32/40 (77.5)] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous surgery [n (%)]: 8/40 (20.0) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group: elemental nutrition (with restricted food diet) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 2 group: no intervention (i.e. normal unrestricted diet) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group: NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Outcomes (study based) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primary outcomes (list): clinical and endoscopic recurrence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Measure of disease activity (clinical, endoscopic): clinical (CDAI score), endoscopic (Rutgeerts score) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of remission (clinical, endoscopic): CDAI score of < 150 points (clinical), Rutgeerts score < 2 (endoscopic) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of relapse/recurrence (clinical, endoscopic): clinical (at 6, 12 months: CDAI score of ≥ 150 points; at 60 months: CDAI score of ≥ 200 points), endoscopic (Rutgeerts score ≥ 2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of mucosal healing (clinical, endoscopic): NR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline timings of primary outcome assessment: 6 and 12 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of patients | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TotalElemental nutrition groupNo intervention groupIntervention 3 groupAllocated to treatment402020NAAnalysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one)40 (ITT)2020NALosses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one)000NAITT, intention to treat; NA, not applicable; PP, per protocol. | Total | Elemental nutrition group | No intervention group | Intervention 3 group | Allocated to treatment | 40 | 20 | 20 | NA | Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 40 (ITT) | 20 | 20 | NA | Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 0 | 0 | 0 | NA | ITT, intention to treat; NA, not applicable; PP, per protocol. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total | Elemental nutrition group | No intervention group | Intervention 3 group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allocated to treatment | 40 | 20 | 20 | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 40 (ITT) | 20 | 20 | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 0 | 0 | 0 | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ITT, intention to treat; NA, not applicable; PP, per protocol. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Interventions | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration)DietCo-interventionElemental nutrition groupElental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) with the calorie density of 1 kcal/ml with an osmolarity of 760 mOsm/l. Infused at home nasogastrically via self-intubated tube in the night-time 1 week after operation. The concentration of the elemental nutrition was gradually increased from one-third to the full strength over 10 days (adaptation phase) to reduce side effects, such as diarrhoea and abdominal colic. After the adaptation phase, a maintenance dose at the full strength was administered in the night-time (for 6–10 hours). The volume of the elemental nutrition infused per night was 1200–1800 mlPentasa 3000 mg/day as a prophylactic medicationRestricted food diet: in the daytime, low-fat foods (20–30 g/day) were taken according to the instructions of their dieticians. The daily calorie intake was 35–40 kcal/kg body weight; about half of the calorie was obtained from the elemental nutrition therapyNo corticosteroid, immunosuppressive drugs or infliximab except patients who relapsedDuration at least 12 monthsNo intervention groupNo elemental nutrition, only normal unrestricted dietPentasa 3000 mg/day as a prophylactic medicationDuration > 12 monthsNo corticosteroid, immunosuppressive drugs or infliximab except patients who relapsedIntervention 3 groupNANANA, not applicable. | Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | Diet | Co-intervention | Elemental nutrition group | Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) with the calorie density of 1 kcal/ml with an osmolarity of 760 mOsm/l. Infused at home nasogastrically via self-intubated tube in the night-time 1 week after operation. The concentration of the elemental nutrition was gradually increased from one-third to the full strength over 10 days (adaptation phase) to reduce side effects, such as diarrhoea and abdominal colic. After the adaptation phase, a maintenance dose at the full strength was administered in the night-time (for 6–10 hours). The volume of the elemental nutrition infused per night was 1200–1800 ml | Pentasa 3000 mg/day as a prophylactic medication | Restricted food diet: in the daytime, low-fat foods (20–30 g/day) were taken according to the instructions of their dieticians. The daily calorie intake was 35–40 kcal/kg body weight; about half of the calorie was obtained from the elemental nutrition therapy | No corticosteroid, immunosuppressive drugs or infliximab except patients who relapsed | Duration at least 12 months | No intervention group | No elemental nutrition, only normal unrestricted diet | Pentasa 3000 mg/day as a prophylactic medication | Duration > 12 months | No corticosteroid, immunosuppressive drugs or infliximab except patients who relapsed | Intervention 3 group | NA | NA | NA, not applicable. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diet | Co-intervention | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) with the calorie density of 1 kcal/ml with an osmolarity of 760 mOsm/l. Infused at home nasogastrically via self-intubated tube in the night-time 1 week after operation. The concentration of the elemental nutrition was gradually increased from one-third to the full strength over 10 days (adaptation phase) to reduce side effects, such as diarrhoea and abdominal colic. After the adaptation phase, a maintenance dose at the full strength was administered in the night-time (for 6–10 hours). The volume of the elemental nutrition infused per night was 1200–1800 ml | Pentasa 3000 mg/day as a prophylactic medication | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Restricted food diet: in the daytime, low-fat foods (20–30 g/day) were taken according to the instructions of their dieticians. The daily calorie intake was 35–40 kcal/kg body weight; about half of the calorie was obtained from the elemental nutrition therapy | No corticosteroid, immunosuppressive drugs or infliximab except patients who relapsed | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration at least 12 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No intervention group | No elemental nutrition, only normal unrestricted diet | Pentasa 3000 mg/day as a prophylactic medication | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration > 12 months | No corticosteroid, immunosuppressive drugs or infliximab except patients who relapsed | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patient baseline characteristics | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupNo Intervention groupIntervention 3 groupAge (years), mean (SD)31.0 (16.5)33.0 (17.4)NAGender (female), n/N (%)8/20 (40.0)6/20 (30.0)NAWeight (kg), mean (SD)NRNRNABMI (kg/m2), mean (SD)NRNRNASmoking, n/N (%)2/20 (10.0)2/20 (10.0)NAPrevious bowel resection, n/N (%)20/20 (100.0)20/20 (100.0)NADuration of CD (months), mean (SD)37.0 (31.7)39.0 (36.7)NACDAI score (points), mean (SD)NRNRNACrohn’s Disease Endoscopic Index of Severity, mean (SD)NRNRNADisease activity other than CDAI (specify)NRNRNAMucosal ulceration, n/N (%)NRNRNAOther complications, n/N (%)Diarrhoea, abdominal distension or colic in most patients (n/N: NR)NRNANA, not applicable; NR, not reported. | Elemental nutrition group | No Intervention group | Intervention 3 group | Age (years), mean (SD) | 31.0 (16.5) | 33.0 (17.4) | NA | Gender (female), n/N (%) | 8/20 (40.0) | 6/20 (30.0) | NA | Weight (kg), mean (SD) | NR | NR | NA | BMI (kg/m2), mean (SD) | NR | NR | NA | Smoking, n/N (%) | 2/20 (10.0) | 2/20 (10.0) | NA | Previous bowel resection, n/N (%) | 20/20 (100.0) | 20/20 (100.0) | NA | Duration of CD (months), mean (SD) | 37.0 (31.7) | 39.0 (36.7) | NA | CDAI score (points), mean (SD) | NR | NR | NA | Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | Disease activity other than CDAI (specify) | NR | NR | NA | Mucosal ulceration, n/N (%) | NR | NR | NA | Other complications, n/N (%) | Diarrhoea, abdominal distension or colic in most patients (n/N: NR) | NR | NA | NA, not applicable; NR, not reported. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | No Intervention group | Intervention 3 group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Age (years), mean (SD) | 31.0 (16.5) | 33.0 (17.4) | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gender (female), n/N (%) | 8/20 (40.0) | 6/20 (30.0) | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean (SD) | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smoking, n/N (%) | 2/20 (10.0) | 2/20 (10.0) | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous bowel resection, n/N (%) | 20/20 (100.0) | 20/20 (100.0) | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of CD (months), mean (SD) | 37.0 (31.7) | 39.0 (36.7) | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Disease activity other than CDAI (specify) | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mucosal ulceration, n/N (%) | NR | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other complications, n/N (%) | Diarrhoea, abdominal distension or colic in most patients (n/N: NR) | NR | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Efficacy outcomes | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For each timing of assessment please provide a separate table | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For scores, extract only total scores | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline follow-up assessment timing (specify): 6, 12, 60 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupNo Intervention groupIntervention 3 groupBetween-group difference, p-value (or 95% CI)aPatients remaining in remission, n/N (%)12 months: 19/20 (95.0)12 months: 13/20 (65.0)NAp = NR. RR 1.46 (1.04 to 2.05) calculated; in favour of elemental groupDuration of remission (months, mean (SD) or 95% CINRNRNANARisk of relapse or recurrence, n/N (%)ClinicalClinicalClinical at 12 months 12 months: 1/20 (5.0) 12 months: 7/20 (35.0) p = 0.048 (SS), study reported; RR 0.14 (0.02 to 1.00) calculated; in favour of elemental group 60 months: 6/20 (30.0) 60 months: 12/20 (60.0)Clinical at 60 monthsEndoscopicEndoscopic p = 0.11 (NS), study reported; RR 0.50 (0.23 to 1.07) calculated 6 months: 5/20 (25.0) 6 months: 8/20 (40.0)Endoscopic at 6 months 12 months: 6/20 (30.0) 12 months: 14/20 (70.0) p = 0.50 (NS), study reported; RR 0.62 (0.24 to 1.58) calculated 60 months: 9/16 (56.2) 60 months: 14/17 (82.3)Endoscopic at 12 months p = 0.027 (SS), study reported; RR 0.42 (0.20 to 0.88) calculated; in favour of elemental groupEndoscopic at 60 months p = 0.21 (NS), study reported; RR 0.68 (0.42 to 1.11) calculatedTime to relapse (months), mean (SD) or 95% CINRNRNANASurvival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI)NRNRNANAPatients achieving mucosal healing, n/N (%)NRNRNANACDAI score (points), mean (SD)NRNRNANAThe Short Form Health Survey (SF-36), mean (SD) 95% CINRNRNANAThe Short Form Health Survey (SF-12), mean (SD) 95% CINRNRNANAThe EQ-5D questionnaire, mean (SD) 95% CINRNRNANAOther HRQoL (specify), mean (SD) 95% CINRNRNANAWeight (kg), mean (SD) 95% CINRNRNANAWeight gain (kg), mean change (SD) 95% CINRNRNANABMI (kg/m2), mean change (SD) 95% CINRNRNANAHeight gain (cm), mean (SD) 95% CINRNRNANALinear growth rate (mean height-for-age z-value)NRNRNANAAdherence, n/N (%)20/20 (100.0) (12 months)20/20 (100.0) (12 months)NANo difference (12 months), RR 0.80 (0.64 to 0.99) calculated; in favour of the control group (60 months)16/20 (80.0) (60 months)20/20 (100.0) (60 months)Need for surgery, n/N (%)1/20 (5.0) (60 months)5/20 (25.0) (60 months)NAp = 0.18 (NS), study reported; RR 0.20 (0.02 to 1.56) calculated (60 months)Steroid dose tapering, n/N (%)NRNRNANAWithdrawal from steroids, n/N (%)NRNRNANAAdverse events due to treatment, n/N (%)NRNRNANAEQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant.a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). | Elemental nutrition group | No Intervention group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | Patients remaining in remission, n/N (%) | 12 months: 19/20 (95.0) | 12 months: 13/20 (65.0) | NA | p = NR. RR 1.46 (1.04 to 2.05) calculated; in favour of elemental group | Duration of remission (months, mean (SD) or 95% CI | NR | NR | NA | NA | Risk of relapse or recurrence, n/N (%) | Clinical | Clinical | Clinical at 12 months | 12 months: 1/20 (5.0) | 12 months: 7/20 (35.0) | p = 0.048 (SS), study reported; RR 0.14 (0.02 to 1.00) calculated; in favour of elemental group | 60 months: 6/20 (30.0) | 60 months: 12/20 (60.0) | Clinical at 60 months | Endoscopic | Endoscopic | p = 0.11 (NS), study reported; RR 0.50 (0.23 to 1.07) calculated | 6 months: 5/20 (25.0) | 6 months: 8/20 (40.0) | Endoscopic at 6 months | 12 months: 6/20 (30.0) | 12 months: 14/20 (70.0) | p = 0.50 (NS), study reported; RR 0.62 (0.24 to 1.58) calculated | 60 months: 9/16 (56.2) | 60 months: 14/17 (82.3) | Endoscopic at 12 months | p = 0.027 (SS), study reported; RR 0.42 (0.20 to 0.88) calculated; in favour of elemental group | Endoscopic at 60 months | p = 0.21 (NS), study reported; RR 0.68 (0.42 to 1.11) calculated | Time to relapse (months), mean (SD) or 95% CI | NR | NR | NA | NA | Survival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI) | NR | NR | NA | NA | Patients achieving mucosal healing, n/N (%) | NR | NR | NA | NA | CDAI score (points), mean (SD) | NR | NR | NA | NA | The Short Form Health Survey (SF-36), mean (SD) 95% CI | NR | NR | NA | NA | The Short Form Health Survey (SF-12), mean (SD) 95% CI | NR | NR | NA | NA | The EQ-5D questionnaire, mean (SD) 95% CI | NR | NR | NA | NA | Other HRQoL (specify), mean (SD) 95% CI | NR | NR | NA | NA | Weight (kg), mean (SD) 95% CI | NR | NR | NA | NA | Weight gain (kg), mean change (SD) 95% CI | NR | NR | NA | NA | BMI (kg/m2), mean change (SD) 95% CI | NR | NR | NA | NA | Height gain (cm), mean (SD) 95% CI | NR | NR | NA | NA | Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | Adherence, n/N (%) | 20/20 (100.0) (12 months) | 20/20 (100.0) (12 months) | NA | No difference (12 months), RR 0.80 (0.64 to 0.99) calculated; in favour of the control group (60 months) | 16/20 (80.0) (60 months) | 20/20 (100.0) (60 months) | Need for surgery, n/N (%) | 1/20 (5.0) (60 months) | 5/20 (25.0) (60 months) | NA | p = 0.18 (NS), study reported; RR 0.20 (0.02 to 1.56) calculated (60 months) | Steroid dose tapering, n/N (%) | NR | NR | NA | NA | Withdrawal from steroids, n/N (%) | NR | NR | NA | NA | Adverse events due to treatment, n/N (%) | NR | NR | NA | NA | EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
||||||||||||||||||||||||
| Elemental nutrition group | No Intervention group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients remaining in remission, n/N (%) | 12 months: 19/20 (95.0) | 12 months: 13/20 (65.0) | NA | p = NR. RR 1.46 (1.04 to 2.05) calculated; in favour of elemental group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of remission (months, mean (SD) or 95% CI | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Risk of relapse or recurrence, n/N (%) | Clinical | Clinical | Clinical at 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 months: 1/20 (5.0) | 12 months: 7/20 (35.0) | p = 0.048 (SS), study reported; RR 0.14 (0.02 to 1.00) calculated; in favour of elemental group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 60 months: 6/20 (30.0) | 60 months: 12/20 (60.0) | Clinical at 60 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Endoscopic | Endoscopic | p = 0.11 (NS), study reported; RR 0.50 (0.23 to 1.07) calculated | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 months: 5/20 (25.0) | 6 months: 8/20 (40.0) | Endoscopic at 6 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12 months: 6/20 (30.0) | 12 months: 14/20 (70.0) | p = 0.50 (NS), study reported; RR 0.62 (0.24 to 1.58) calculated | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 60 months: 9/16 (56.2) | 60 months: 14/17 (82.3) | Endoscopic at 12 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.027 (SS), study reported; RR 0.42 (0.20 to 0.88) calculated; in favour of elemental group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Endoscopic at 60 months | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p = 0.21 (NS), study reported; RR 0.68 (0.42 to 1.11) calculated | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Time to relapse (months), mean (SD) or 95% CI | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Survival rate (% patients in remission who have not relapsed) (Kaplan–Meier estimate and 95% CI) | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients achieving mucosal healing, n/N (%) | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-36), mean (SD) 95% CI | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-12), mean (SD) 95% CI | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The EQ-5D questionnaire, mean (SD) 95% CI | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other HRQoL (specify), mean (SD) 95% CI | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) 95% CI | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight gain (kg), mean change (SD) 95% CI | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean change (SD) 95% CI | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Height gain (cm), mean (SD) 95% CI | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adherence, n/N (%) | 20/20 (100.0) (12 months) | 20/20 (100.0) (12 months) | NA | No difference (12 months), RR 0.80 (0.64 to 0.99) calculated; in favour of the control group (60 months) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16/20 (80.0) (60 months) | 20/20 (100.0) (60 months) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Need for surgery, n/N (%) | 1/20 (5.0) (60 months) | 5/20 (25.0) (60 months) | NA | p = 0.18 (NS), study reported; RR 0.20 (0.02 to 1.56) calculated (60 months) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Steroid dose tapering, n/N (%) | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Withdrawal from steroids, n/N (%) | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adverse events due to treatment, n/N (%) | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Complications: number (%) of patients with an event (if more than one follow-up, choose and specify the last follow-up) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupNo Intervention groupIntervention 3 groupBetween-group difference, p-value (or 95% CI)aImpaired growth, n/N (%)NRNRNANADelay in pubertal development, n/N (%)NRNRNANABowel obstructionNRNRNANAFistulaeNRNRNANAAbscessNRNRNANAColon/bowel cancerNRNRNANAIntestinal infectionNRNRNANAOthers (specify)NRNRNANANA, not applicable; NR, not reported.a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). | Elemental nutrition group | No Intervention group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | Impaired growth, n/N (%) | NR | NR | NA | NA | Delay in pubertal development, n/N (%) | NR | NR | NA | NA | Bowel obstruction | NR | NR | NA | NA | Fistulae | NR | NR | NA | NA | Abscess | NR | NR | NA | NA | Colon/bowel cancer | NR | NR | NA | NA | Intestinal infection | NR | NR | NA | NA | Others (specify) | NR | NR | NA | NA | NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | No Intervention group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Impaired growth, n/N (%) | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Delay in pubertal development, n/N (%) | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bowel obstruction | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fistulae | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abscess | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Colon/bowel cancer | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intestinal infection | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Others (specify) | NR | NR | NA | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Authors conclusion | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The long-term enteral nutritional therapy significantly reduced clinical and endoscopic recurrence after resection for CD | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reviewer’s conclusion | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Assignment depended on compliance, i.e. patients with good compliance were assigned to elemental nutrition group and those with low compliance to control group. The long-term enteral nutritional therapy significantly reduced clinical and endoscopic recurrence at 12 months after resection for CD; however, at 60 months the rates of clinical/endoscopic recurrences as well as the need for operation were not significantly different between the two treatment groups; compliance rates were better in the control group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Tara Gurung
| Study details | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| First author surname year of publication: Yamamoto 200757 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Country: Japan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study design: nRCT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study setting (primary care/specialty clinic/other – specify): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of centres: one | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total length of follow-up: 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Funding (government/private/manufacturer/other – specify): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aim of the study | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| To investigate if long-term enteral nutrition (vs. no intervention) is effective in reducing clinical and endoscopic relapse rates and inhibiting mucosal cytokine production in patients with quiescent CD | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Participants | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Recruitment dates: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients who received induction therapy: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients achieving remission after induction therapy: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients unable to achieve remission after induction therapy: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients excluded before start of maintenance therapy (e.g. in relapse, lost to follow-up): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients allocated to maintenance treatment: 40 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inclusion criteria: patient with endoscopic/histological diagnosis of CD in the terminal ileum and/or the colon; age: 15–75 years; clinical remission (CDAI score of < 150 points) after medical treatment; the duration from the induction of remission to entry < 8 weeks; patient had experienced enteral nutrition therapy including elemental nutrition infusion at least one time before entry; patient agreed to continue with assigned treatment (with or without enteral nutrition) for > 1 year; and patient agreed to have ileocolonoscopy with multiple mucosal biopsies even if they did not have any clinical symptoms | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Exclusion criteria: diffuse jejunoileal or gastroduodenal; severe anorectal stricture or sepsis; tight bowel strictures or enteric fistulae even though clinical symptoms were quiescent; patient had received corticosteroids, immunosuppressive drugs or infliximab at entry | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Characteristics of participants (total study sample) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean (range or SD) age (years): mean 29.0–31.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Women [n (%)]: 13/40 (32.5) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Race/ethnicity [n (%)]: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diagnostic criteria for CD: endoscopic and histological (not specified) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean CDAI score (points) (range or SD): 97 (56–139) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD location [n (%)]: terminal ileum [15/40 (37.5)], colon [4/40 (10)], terminal ileum and colon [21/40 (52.5)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Type of induction therapy (e.g. medical, surgical): 4 patients (5 mg/kg × 1 or × 3 prednisolone, infliximab), 6 patients (prednisolone with enteral nutrition), 10 patients (prednisolone alone), 20 patients (enteral nutrition alone), 36 patients (Pentasa, 750–3000 mg/day), and the majority of patients required parenteral nutrition at the start of the treatment | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous surgery [n (%)]: 8/40 (20) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group: elemental nutrition (with restricted food diet) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 2 group: no intervention (i.e. normal unrestricted diet) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group: NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Outcomes (study based) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primary outcomes (list): CDAI score, cumulative proportion of patients maintaining clinical remission (CDAI score of < 150 points), endoscopic severity of disease activity/mucosal inflammation, mucosal cytokine assays | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Measure of disease activity (clinical, endoscopic): CDAI score (clinical), mucosal inflammation grade by Wardle et al.,62 as reported by Yamamoto 2007,57 (0 = macroscopically normal, 1 = granular mucosa and contact bleeding, 2 = erythematous and oedematous mucosa, aphthoid or superficial ulcers, and 3 = deep ulcers with slough and inflammatory pseudopolyps) (endoscopic) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of remission (clinical, endoscopic): CDAI score of < 150 points (clinical), NR (endoscopic; specific threshold for the mucosal inflammation grade NR) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of relapse/recurrence (clinical, endoscopic): CDAI score of ≥ 150 points (clinical), NR (endoscopic; specific threshold for the mucosal inflammation grade NR) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of mucosal healing (clinical, endoscopic): endoscopic (specific threshold for the mucosal inflammation grade NR) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline timings of primary outcome assessment: 0, 6 and 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of patients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TotalElemental nutrition groupNo intervention groupIntervention 3 groupAllocated to treatment402020NAAnalysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one)40 (ITT)2020NALosses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one)000NAITT, intention to treat; PP, per protocol. | Total | Elemental nutrition group | No intervention group | Intervention 3 group | Allocated to treatment | 40 | 20 | 20 | NA | Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 40 (ITT) | 20 | 20 | NA | Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 0 | 0 | 0 | NA | ITT, intention to treat; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total | Elemental nutrition group | No intervention group | Intervention 3 group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allocated to treatment | 40 | 20 | 20 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 40 (ITT) | 20 | 20 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 0 | 0 | 0 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ITT, intention to treat; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Interventions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration)DietCo-interventionElemental nutrition groupElemental nutrition: Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan); one pack contains 80 g of powdered elemental nutrition, dissolved in warm water to give 300 ml of solution; 1200–1800 ml/night infused via self-intubated nasogastric tube every night; patients were advised to take 35–40 kcal/kg IBW daily and to take approximately half of the calorie from the enteral nutritionPentasa 3000 mg/day as a prophylactic medicationRestricted food diet: in the daytime, a low-fat diet (20–30 g/day) was taken in accord with dietician’s instructionsNo corticosteroid, immunosuppressive drugs or infliximab except patients who relapsedDuration > 12 monthsNo intervention groupNo elemental nutrition, only normal unrestricted dietPentasa 3000 mg/day as a prophylactic medicationDuration > 12 monthsNo corticosteroid, immunosuppressive drugs or infliximab except patients who relapsedIntervention 3 groupNANAIBW, ideal body weight; NA, not applicable. | Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | Diet | Co-intervention | Elemental nutrition group | Elemental nutrition: Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan); one pack contains 80 g of powdered elemental nutrition, dissolved in warm water to give 300 ml of solution; 1200–1800 ml/night infused via self-intubated nasogastric tube every night; patients were advised to take 35–40 kcal/kg IBW daily and to take approximately half of the calorie from the enteral nutrition | Pentasa 3000 mg/day as a prophylactic medication | Restricted food diet: in the daytime, a low-fat diet (20–30 g/day) was taken in accord with dietician’s instructions | No corticosteroid, immunosuppressive drugs or infliximab except patients who relapsed | Duration > 12 months | No intervention group | No elemental nutrition, only normal unrestricted diet | Pentasa 3000 mg/day as a prophylactic medication | Duration > 12 months | No corticosteroid, immunosuppressive drugs or infliximab except patients who relapsed | Intervention 3 group | NA | NA | IBW, ideal body weight; NA, not applicable. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diet | Co-intervention | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | Elemental nutrition: Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan); one pack contains 80 g of powdered elemental nutrition, dissolved in warm water to give 300 ml of solution; 1200–1800 ml/night infused via self-intubated nasogastric tube every night; patients were advised to take 35–40 kcal/kg IBW daily and to take approximately half of the calorie from the enteral nutrition | Pentasa 3000 mg/day as a prophylactic medication | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Restricted food diet: in the daytime, a low-fat diet (20–30 g/day) was taken in accord with dietician’s instructions | No corticosteroid, immunosuppressive drugs or infliximab except patients who relapsed | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration > 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No intervention group | No elemental nutrition, only normal unrestricted diet | Pentasa 3000 mg/day as a prophylactic medication | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration > 12 months | No corticosteroid, immunosuppressive drugs or infliximab except patients who relapsed | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IBW, ideal body weight; NA, not applicable. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patient baseline characteristics | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupNo Intervention groupIntervention 3 groupAge (years), mean (SD)29.0 (17.4)31.0 (20.1)NAGender – (female), n/N (%)6/20 (30.0)7/20 (35.0)NAWeight (kg), mean (SD)51.1 (8.5)48.9 (7.6)NABMI (kg/m2), mean (SD)19.2 (1.3)19.1 (1.8)NASmoking, n/N (%)2/20 (10.0)4/20 (20.0)NAPrevious bowel resection, n/N (%)4/20 (20.0)4/20 (20.0)NADuration of CD (months), mean (SD)32.0 (35.3)36.0 (38.9)NACDAI score (points), mean (SD)101.0 (28.2)92.0 (21.5)NACrohn’s Disease Endoscopic Index of Severity, mean (SD)NRNRNADisease activity other than CDAI (endoscopic mucosal inflammation grade 0–3)Grade 0: 8/20 (40.0)Grade 0: 9/20 (45.0)NAGrade 1: 7/20 (35.0)Grade 1: 7/20 (35.0)Grade 2: 3/20 (15.0)Grade 2: 2/20 (10.0)Grade 3: 2/20 (10.0)Grade 3: 2/20 (10.0)Mucosal ulceration, n/N (%)NR (see above endoscopic mucosal inflammation grade)NR (see above endoscopic mucosal inflammation grade)NAOther complications, n/N (%)Diarrhoea, abdominal distension or colic in most patients (n/N: NR)NRNANA, not applicable; NR, not reported. | Elemental nutrition group | No Intervention group | Intervention 3 group | Age (years), mean (SD) | 29.0 (17.4) | 31.0 (20.1) | NA | Gender – (female), n/N (%) | 6/20 (30.0) | 7/20 (35.0) | NA | Weight (kg), mean (SD) | 51.1 (8.5) | 48.9 (7.6) | NA | BMI (kg/m2), mean (SD) | 19.2 (1.3) | 19.1 (1.8) | NA | Smoking, n/N (%) | 2/20 (10.0) | 4/20 (20.0) | NA | Previous bowel resection, n/N (%) | 4/20 (20.0) | 4/20 (20.0) | NA | Duration of CD (months), mean (SD) | 32.0 (35.3) | 36.0 (38.9) | NA | CDAI score (points), mean (SD) | 101.0 (28.2) | 92.0 (21.5) | NA | Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | Disease activity other than CDAI (endoscopic mucosal inflammation grade 0–3) | Grade 0: 8/20 (40.0) | Grade 0: 9/20 (45.0) | NA | Grade 1: 7/20 (35.0) | Grade 1: 7/20 (35.0) | Grade 2: 3/20 (15.0) | Grade 2: 2/20 (10.0) | Grade 3: 2/20 (10.0) | Grade 3: 2/20 (10.0) | Mucosal ulceration, n/N (%) | NR (see above endoscopic mucosal inflammation grade) | NR (see above endoscopic mucosal inflammation grade) | NA | Other complications, n/N (%) | Diarrhoea, abdominal distension or colic in most patients (n/N: NR) | NR | NA | NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | No Intervention group | Intervention 3 group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Age (years), mean (SD) | 29.0 (17.4) | 31.0 (20.1) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gender – (female), n/N (%) | 6/20 (30.0) | 7/20 (35.0) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) | 51.1 (8.5) | 48.9 (7.6) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean (SD) | 19.2 (1.3) | 19.1 (1.8) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smoking, n/N (%) | 2/20 (10.0) | 4/20 (20.0) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous bowel resection, n/N (%) | 4/20 (20.0) | 4/20 (20.0) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of CD (months), mean (SD) | 32.0 (35.3) | 36.0 (38.9) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | 101.0 (28.2) | 92.0 (21.5) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Disease activity other than CDAI (endoscopic mucosal inflammation grade 0–3) | Grade 0: 8/20 (40.0) | Grade 0: 9/20 (45.0) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grade 1: 7/20 (35.0) | Grade 1: 7/20 (35.0) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grade 2: 3/20 (15.0) | Grade 2: 2/20 (10.0) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grade 3: 2/20 (10.0) | Grade 3: 2/20 (10.0) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mucosal ulceration, n/N (%) | NR (see above endoscopic mucosal inflammation grade) | NR (see above endoscopic mucosal inflammation grade) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other complications, n/N (%) | Diarrhoea, abdominal distension or colic in most patients (n/N: NR) | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Efficacy outcomes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For each timing of assessment please provide a separate table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For scores, extract only total scores | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline follow-up assessment timing (specify): 12 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupNo Intervention groupIntervention 3 groupBetween-group difference, p-value (or 95% CI)aPatients remaining in remission, n/N (%)15/20 (75.0)7/20 (35.0)NAp = 0.01 study reported SS. RR 2.14 (1.12 to 4.10) SS calculated; in favour of elemental nutrition groupDuration of remission (months), mean (SD) or 95% CINRNRNANARisk of relapse or recurrence, n/N (%)5/20 (25.0)13/20 (65.0)NAOR 0.20. p = 0.03 (study reported) (0.04 to 0.70) calculated. RR 0.38 (0.16 to 0.87) calculated. (SS) in favour of elemental nutrition groupTime to relapse (months), mean (SD) or 95% CINRNRNANASurvival rate (% patients in remission who have not relapsed), Kaplan–Meier estimate and 95% CINRNRNAp = 0.01 (SS) in favour of elemental nutrition groupPatients achieving mucosal healing, n/N (%)Grade 0: 6/20 (30.0)Grade 0: 2/18 (11.1)NARR 2.70 (0.62 to 11.72) (NS), calculatedCDAI score (points), mean (SD)NRNRNAp = 0.04 (SS) in favour of elemental nutrition groupThe Short Form Health Survey (SF-36), mean (SD) 95% CINRNRNANAThe Short Form Health Survey (SF-12), mean (SD) 95% CINRNRNANAThe EQ-5D questionnaire, mean (SD) 95% CINRNRNANAOther HRQoL (specify), mean (SD) 95% CINRNRNANAWeight (kg), mean (SD) 95% CINRNRNANS (p > 0.05)Weight gain (kg), mean change (SD) 95% CINRNRNANABMI (kg/m2), mean change (SD) 95% CINRNRNASS (p < 0.05) in favour of elemental nutrition groupHeight gain (cm), mean (SD) 95% CINRNRNANALinear growth rate (mean height-for-age z-value)NRNRNANAAdherence, n/N (%)18/20 (90.0)20/20 (100.0)NAp = 0.48 Fisher test (NS)Need for surgery, n/N (%)0/20 (0.0)2/20 (10.0)NANRSteroid dose tapering, n/N (%)NANANANAWithdrawal from steroids, n/N (%)NANANANAAdverse events due to treatment, n/N (%)NRNRNANAEQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; SS, statistically significant.a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). | Elemental nutrition group | No Intervention group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | Patients remaining in remission, n/N (%) | 15/20 (75.0) | 7/20 (35.0) | NA | p = 0.01 study reported SS. RR 2.14 (1.12 to 4.10) SS calculated; in favour of elemental nutrition group | Duration of remission (months), mean (SD) or 95% CI | NR | NR | NA | NA | Risk of relapse or recurrence, n/N (%) | 5/20 (25.0) | 13/20 (65.0) | NA | OR 0.20. p = 0.03 (study reported) (0.04 to 0.70) calculated. RR 0.38 (0.16 to 0.87) calculated. (SS) in favour of elemental nutrition group | Time to relapse (months), mean (SD) or 95% CI | NR | NR | NA | NA | Survival rate (% patients in remission who have not relapsed), Kaplan–Meier estimate and 95% CI | NR | NR | NA | p = 0.01 (SS) in favour of elemental nutrition group | Patients achieving mucosal healing, n/N (%) | Grade 0: 6/20 (30.0) | Grade 0: 2/18 (11.1) | NA | RR 2.70 (0.62 to 11.72) (NS), calculated | CDAI score (points), mean (SD) | NR | NR | NA | p = 0.04 (SS) in favour of elemental nutrition group | The Short Form Health Survey (SF-36), mean (SD) 95% CI | NR | NR | NA | NA | The Short Form Health Survey (SF-12), mean (SD) 95% CI | NR | NR | NA | NA | The EQ-5D questionnaire, mean (SD) 95% CI | NR | NR | NA | NA | Other HRQoL (specify), mean (SD) 95% CI | NR | NR | NA | NA | Weight (kg), mean (SD) 95% CI | NR | NR | NA | NS (p > 0.05) | Weight gain (kg), mean change (SD) 95% CI | NR | NR | NA | NA | BMI (kg/m2), mean change (SD) 95% CI | NR | NR | NA | SS (p < 0.05) in favour of elemental nutrition group | Height gain (cm), mean (SD) 95% CI | NR | NR | NA | NA | Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | Adherence, n/N (%) | 18/20 (90.0) | 20/20 (100.0) | NA | p = 0.48 Fisher test (NS) | Need for surgery, n/N (%) | 0/20 (0.0) | 2/20 (10.0) | NA | NR | Steroid dose tapering, n/N (%) | NA | NA | NA | NA | Withdrawal from steroids, n/N (%) | NA | NA | NA | NA | Adverse events due to treatment, n/N (%) | NR | NR | NA | NA | EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; SS, statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). |
|||||
| Elemental nutrition group | No Intervention group | Intervention 3 group | Between-group difference, p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients remaining in remission, n/N (%) | 15/20 (75.0) | 7/20 (35.0) | NA | p = 0.01 study reported SS. RR 2.14 (1.12 to 4.10) SS calculated; in favour of elemental nutrition group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of remission (months), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Risk of relapse or recurrence, n/N (%) | 5/20 (25.0) | 13/20 (65.0) | NA | OR 0.20. p = 0.03 (study reported) (0.04 to 0.70) calculated. RR 0.38 (0.16 to 0.87) calculated. (SS) in favour of elemental nutrition group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Time to relapse (months), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Survival rate (% patients in remission who have not relapsed), Kaplan–Meier estimate and 95% CI | NR | NR | NA | p = 0.01 (SS) in favour of elemental nutrition group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients achieving mucosal healing, n/N (%) | Grade 0: 6/20 (30.0) | Grade 0: 2/18 (11.1) | NA | RR 2.70 (0.62 to 11.72) (NS), calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | NR | NR | NA | p = 0.04 (SS) in favour of elemental nutrition group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-36), mean (SD) 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-12), mean (SD) 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The EQ-5D questionnaire, mean (SD) 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other HRQoL (specify), mean (SD) 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) 95% CI | NR | NR | NA | NS (p > 0.05) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight gain (kg), mean change (SD) 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean change (SD) 95% CI | NR | NR | NA | SS (p < 0.05) in favour of elemental nutrition group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Height gain (cm), mean (SD) 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adherence, n/N (%) | 18/20 (90.0) | 20/20 (100.0) | NA | p = 0.48 Fisher test (NS) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Need for surgery, n/N (%) | 0/20 (0.0) | 2/20 (10.0) | NA | NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Steroid dose tapering, n/N (%) | NA | NA | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Withdrawal from steroids, n/N (%) | NA | NA | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adverse events due to treatment, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; SS, statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Complications: number (%) of patients with an event (if more than one follow-up, choose and specify the last follow-up) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition groupNo Intervention groupIntervention 3 groupBetween-group difference p-value (or 95% CI)aImpaired growth, n/N (%)NRNRNANADelay in pubertal development, n/N (%)NRNRNANABowel obstructionNRNRNANAFistulaeNRNRNANAAbscessNRNRNANAColon/bowel cancerNRNRNANAIntestinal infectionNRNRNANAOthers (specify)NRNRNANANA, not applicable; NR, not reported.a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). | Elemental nutrition group | No Intervention group | Intervention 3 group | Between-group difference p-value (or 95% CI)a | Impaired growth, n/N (%) | NR | NR | NA | NA | Delay in pubertal development, n/N (%) | NR | NR | NA | NA | Bowel obstruction | NR | NR | NA | NA | Fistulae | NR | NR | NA | NA | Abscess | NR | NR | NA | NA | Colon/bowel cancer | NR | NR | NA | NA | Intestinal infection | NR | NR | NA | NA | Others (specify) | NR | NR | NA | NA | NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group | No Intervention group | Intervention 3 group | Between-group difference p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Impaired growth, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Delay in pubertal development, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bowel obstruction | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fistulae | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abscess | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Colon/bowel cancer | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intestinal infection | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Others (specify) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline; or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Authors conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Long-term enteral nutrition in patients with quiescent CD has a clear suppressive effect on clinical and endoscopic disease activities and the mucosal inflammatory cytokine levels | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reviewer’s conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Assignment depended on compliance, i.e. patients with good compliance were assigned to elemental nutrition group and those with low compliance to control group. The maintenance rates of clinical remission, relapse rates and CDAI scores were significantly better in the elemental nutrition than control group after 12 months of follow-up | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Tara Gurung
| Study details | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| First author surname year of publication: Yamamoto 201058 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Country: Japan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study design: nRCT | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Study setting (primary care/specialty clinic/other – specify): specialty clinic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of centres: one | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total length of follow-up: 14 months | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Funding (government/private/manufacturer/other – specify): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aim of the study | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| To assess the efficacy of elemental nutrition on the maintenance rate of clinical remission in patients with quiescent CD receiving infliximab as maintenance therapy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Participants | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Recruitment dates: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients who received induction therapy: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients achieving remission after induction therapy: 56 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients unable to achieve remission after induction therapy: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients excluded before start of maintenance therapy (e.g. in relapse, lost to follow-up): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total number of patients allocated to maintenance treatment: 56 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Inclusion criteria: patients diagnosed with CD who had achieved clinical remission (CDAI score of < 150 points after infliximab induction therapy) with time from the induction of remission to entry ≤ 2 weeks; patients who had received enteral nutrition including elemental nutrition infusion at least one time before entry; and patients who agreed to continue with the assigned treatment (with or without concomitant enteral nutrition) for 56 weeks | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Exclusion criteria: patients who had severe anorectal involvement; patients who had tight bowel strictures or enteric fistulae even if clinical symptoms were quiescent | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Characteristics of participants (total study sample) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean (range or SD) age (years): 32 (NR) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Women [n (%)]: 20/56 (35.7) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Race/ethnicity [n (%)]: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diagnostic criteria for CD: NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mean CDAI score (points) (range or SD): 102.2 (NR) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CD location [n (%)]: small bowel [22/56 (39.3)], small bowel and colon [34/56 (60.7)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Type of induction therapy (e.g. medical, surgical): medical (infliximab 5 mg/kg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous surgery [n (%)]: bowel resection [19/56 (34.0%)] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition group: elemental nutrition + infliximab 5 mg/kg + restricted low-fat diet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 2 group: Infliximab 5 mg/kg + unrestricted low-fat diet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group: NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Outcomes (study based) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primary outcomes (list): cumulative proportion of patients maintaining clinical remission, CDAI score | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Measure of disease activity (clinical, endoscopic): CDAI score | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of remission (clinical, endoscopic): CDAI score of < 150 points | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of relapse/recurrence (clinical, endoscopic): CDAI score of > 150 points | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Definition of mucosal healing (clinical, endoscopic): NR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline timings of primary outcome assessment: baseline, 8, 16, 24, 32, 40, 48 and 56 weeks | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Number of patients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| TotalElemental nutrition + infliximab groupInfliximab groupIntervention 3 groupAllocated to treatment563224NAAnalysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one)56 (ITT)3224NALosses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one)000NAITT, intention to treat; PP, per protocol. | Total | Elemental nutrition + infliximab group | Infliximab group | Intervention 3 group | Allocated to treatment | 56 | 32 | 24 | NA | Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 56 (ITT) | 32 | 24 | NA | Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 0 | 0 | 0 | NA | ITT, intention to treat; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Total | Elemental nutrition + infliximab group | Infliximab group | Intervention 3 group | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allocated to treatment | 56 | 32 | 24 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Analysed (specify ITT and/or PP) (if more than one follow-up, choose and specify the last one) | 56 (ITT) | 32 | 24 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Losses to follow-up/drop out/sample attrition (if more than one follow-up, choose and specify the last one) | 0 | 0 | 0 | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ITT, intention to treat; PP, per protocol. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Interventions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration)DietCo-interventionElemental nutrition + infliximab groupElemental nutrition (1200–1500 ml) nasogastric tube infusion during night-time; brand: Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan); one Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) pack contained 80 g of powdered elemental diet, which is to be dissolved in warm water to give 300 ml of solution before administration. The calorie density 1 kcal/mlMesalazine (Pentasa 3 g/day), azathioprine (Imuran 50–100 mg/day)Duration: 56 weeks (14 months)Restricted diet – low-fat (20–30 g/day) diet during daytime according to instructions to take 35–40 kcal/kg IBW dailyInfliximab (5 mg/kg, every 8 weeks)Infliximab groupInfliximab (5 mg/kg, every 8 weeks)Mesalazine (Pentasa 3 g/day), azathioprine (Imuran 50–100 mg/day)Unrestricted dietIntervention 3 groupNANAIBW, ideal body weight; NA, not applicable. | Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | Diet | Co-intervention | Elemental nutrition + infliximab group | Elemental nutrition (1200–1500 ml) nasogastric tube infusion during night-time; brand: Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan); one Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) pack contained 80 g of powdered elemental diet, which is to be dissolved in warm water to give 300 ml of solution before administration. The calorie density 1 kcal/ml | Mesalazine (Pentasa 3 g/day), azathioprine (Imuran 50–100 mg/day) | Duration: 56 weeks (14 months) | Restricted diet – low-fat (20–30 g/day) diet during daytime according to instructions to take 35–40 kcal/kg IBW daily | Infliximab (5 mg/kg, every 8 weeks) | Infliximab group | Infliximab (5 mg/kg, every 8 weeks) | Mesalazine (Pentasa 3 g/day), azathioprine (Imuran 50–100 mg/day) | Unrestricted diet | Intervention 3 group | NA | NA | IBW, ideal body weight; NA, not applicable. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Description (e.g. formula manufacturer, calorie content, type, mode, dose and duration of administration) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diet | Co-intervention | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition + infliximab group | Elemental nutrition (1200–1500 ml) nasogastric tube infusion during night-time; brand: Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan); one Elental (Ajinomoto Pharmaceutical Ltd, Tokyo, Japan) pack contained 80 g of powdered elemental diet, which is to be dissolved in warm water to give 300 ml of solution before administration. The calorie density 1 kcal/ml | Mesalazine (Pentasa 3 g/day), azathioprine (Imuran 50–100 mg/day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration: 56 weeks (14 months) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Restricted diet – low-fat (20–30 g/day) diet during daytime according to instructions to take 35–40 kcal/kg IBW daily | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Infliximab (5 mg/kg, every 8 weeks) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Infliximab group | Infliximab (5 mg/kg, every 8 weeks) | Mesalazine (Pentasa 3 g/day), azathioprine (Imuran 50–100 mg/day) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unrestricted diet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intervention 3 group | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IBW, ideal body weight; NA, not applicable. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patient baseline characteristics | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition + infliximab groupInfliximab groupIntervention 3 groupAge (years), mean (SD)31.0 (9.0)33.0 (7.8)NAGender – (female), n/N (%)12/32 (37.5)8/24 (33.3)NAWeight (kg), mean (SD)NRNRNABMI (kg/m2), mean (SD)NRNRNASmoking, n/N (%)4/32 (12.5)4/24 (16.6)NAPrevious bowel resection, n/N (%)11/32 (34.4)8/24 (33.3)NADuration of CD (months), mean (SD)33.0 (24.8)35.0 (19.6)NACDAI score (points), mean (SD)102.1 (18.1)102.3 (22.5)NACrohn’s Disease Endoscopic Index of Severity, mean (SD)NRNRNADisease activity other than CDAI (specify)NRNRNAMucosal ulceration, n/N (%)NRNRNAOther complications, n/N (%)NRNRNANA, not applicable; NR, not reported. | Elemental nutrition + infliximab group | Infliximab group | Intervention 3 group | Age (years), mean (SD) | 31.0 (9.0) | 33.0 (7.8) | NA | Gender – (female), n/N (%) | 12/32 (37.5) | 8/24 (33.3) | NA | Weight (kg), mean (SD) | NR | NR | NA | BMI (kg/m2), mean (SD) | NR | NR | NA | Smoking, n/N (%) | 4/32 (12.5) | 4/24 (16.6) | NA | Previous bowel resection, n/N (%) | 11/32 (34.4) | 8/24 (33.3) | NA | Duration of CD (months), mean (SD) | 33.0 (24.8) | 35.0 (19.6) | NA | CDAI score (points), mean (SD) | 102.1 (18.1) | 102.3 (22.5) | NA | Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | Disease activity other than CDAI (specify) | NR | NR | NA | Mucosal ulceration, n/N (%) | NR | NR | NA | Other complications, n/N (%) | NR | NR | NA | NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition + infliximab group | Infliximab group | Intervention 3 group | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Age (years), mean (SD) | 31.0 (9.0) | 33.0 (7.8) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gender – (female), n/N (%) | 12/32 (37.5) | 8/24 (33.3) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean (SD) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smoking, n/N (%) | 4/32 (12.5) | 4/24 (16.6) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Previous bowel resection, n/N (%) | 11/32 (34.4) | 8/24 (33.3) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of CD (months), mean (SD) | 33.0 (24.8) | 35.0 (19.6) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | 102.1 (18.1) | 102.3 (22.5) | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crohn’s Disease Endoscopic Index of Severity, mean (SD) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Disease activity other than CDAI (specify) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mucosal ulceration, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other complications, n/N (%) | NR | NR | NA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Efficacy outcomes | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For each timing of assessment please provide a separate table | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For scores, extract only total scores | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Post-baseline follow-up assessment timing (specify): 56 weeks (14 months) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition + infliximab groupInfliximab groupIntervention 3 groupBetween-group difference p-value (or 95% CI)aPatients remaining in remission, n/N (%)25/32 (78.1)16/24 (66.6)NAp = 0.51 (NS) study reported. RR 1.17 (0.83 to 1.64) calculatedDuration of remission (months), mean (SD) or 95% CINRNRNANARisk of relapse or recurrence, n/N (%)7/32 (21.8)8/24 (33.3)NAp = 0.51 (NS) study reported. RR 0.65 (0.27 to 1.56) calculatedTime to relapse (months), mean (SD) or 95% CINRNRNANASurvival rate (% patients in remission who have not relapsed), Kaplan–Meier estimate and 95% CINRNRNAp = 0.32 (NS)Patients achieving mucosal healing, n/N (%)NRNRNANACDAI score (points), mean (SD)NRNRNAp > 0.05 (NS)The Short Form Health Survey (SF-36), mean (SD) or 95% CINRNRNANAThe Short Form Health Survey (SF-12), mean (SD) or 95% CINRNRNANAThe EQ-5D questionnaire, mean (SD) or 95% CINRNRNANAOther HRQoL (specify), mean (SD) or 95% CINRNRNANAWeight (kg), mean (SD) or 95% CINRNRNANAWeight gain (kg), mean change (SD) or 95% CINRNRNANABMI (kg/m2), mean change (SD) or 95% CINRNRNANAHeight gain (cm), mean (SD) or 95% CINRNRNANALinear growth rate (mean height-for-age z-value)NRNRNANAAdherence, n/N (%)25/32 (78.1)NRNANANeed for surgery, n/N (%)NRNRNANASteroid dose tapering, n/N (%)NRNRNANAWithdrawal from steroids, n/N (%)NRNRNANAAdverse events due to treatment, n/N (%)NRNRNANAEQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; SS, statistically significant.a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). | Elemental nutrition + infliximab group | Infliximab group | Intervention 3 group | Between-group difference p-value (or 95% CI)a | Patients remaining in remission, n/N (%) | 25/32 (78.1) | 16/24 (66.6) | NA | p = 0.51 (NS) study reported. RR 1.17 (0.83 to 1.64) calculated | Duration of remission (months), mean (SD) or 95% CI | NR | NR | NA | NA | Risk of relapse or recurrence, n/N (%) | 7/32 (21.8) | 8/24 (33.3) | NA | p = 0.51 (NS) study reported. RR 0.65 (0.27 to 1.56) calculated | Time to relapse (months), mean (SD) or 95% CI | NR | NR | NA | NA | Survival rate (% patients in remission who have not relapsed), Kaplan–Meier estimate and 95% CI | NR | NR | NA | p = 0.32 (NS) | Patients achieving mucosal healing, n/N (%) | NR | NR | NA | NA | CDAI score (points), mean (SD) | NR | NR | NA | p > 0.05 (NS) | The Short Form Health Survey (SF-36), mean (SD) or 95% CI | NR | NR | NA | NA | The Short Form Health Survey (SF-12), mean (SD) or 95% CI | NR | NR | NA | NA | The EQ-5D questionnaire, mean (SD) or 95% CI | NR | NR | NA | NA | Other HRQoL (specify), mean (SD) or 95% CI | NR | NR | NA | NA | Weight (kg), mean (SD) or 95% CI | NR | NR | NA | NA | Weight gain (kg), mean change (SD) or 95% CI | NR | NR | NA | NA | BMI (kg/m2), mean change (SD) or 95% CI | NR | NR | NA | NA | Height gain (cm), mean (SD) or 95% CI | NR | NR | NA | NA | Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | Adherence, n/N (%) | 25/32 (78.1) | NR | NA | NA | Need for surgery, n/N (%) | NR | NR | NA | NA | Steroid dose tapering, n/N (%) | NR | NR | NA | NA | Withdrawal from steroids, n/N (%) | NR | NR | NA | NA | Adverse events due to treatment, n/N (%) | NR | NR | NA | NA | EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; SS, statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). |
|||||
| Elemental nutrition + infliximab group | Infliximab group | Intervention 3 group | Between-group difference p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients remaining in remission, n/N (%) | 25/32 (78.1) | 16/24 (66.6) | NA | p = 0.51 (NS) study reported. RR 1.17 (0.83 to 1.64) calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duration of remission (months), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Risk of relapse or recurrence, n/N (%) | 7/32 (21.8) | 8/24 (33.3) | NA | p = 0.51 (NS) study reported. RR 0.65 (0.27 to 1.56) calculated | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Time to relapse (months), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Survival rate (% patients in remission who have not relapsed), Kaplan–Meier estimate and 95% CI | NR | NR | NA | p = 0.32 (NS) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Patients achieving mucosal healing, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CDAI score (points), mean (SD) | NR | NR | NA | p > 0.05 (NS) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-36), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The Short Form Health Survey (SF-12), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| The EQ-5D questionnaire, mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other HRQoL (specify), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight (kg), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weight gain (kg), mean change (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| BMI (kg/m2), mean change (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Height gain (cm), mean (SD) or 95% CI | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Linear growth rate (mean height-for-age z-value) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adherence, n/N (%) | 25/32 (78.1) | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Need for surgery, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Steroid dose tapering, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Withdrawal from steroids, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Adverse events due to treatment, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EQ-5D, European Quality of Life-5 Dimensions; NA, not applicable; NR, not reported; NS, not statistically significant; SS, statistically significant. a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Complications: number (%) of patients with an event (if more than one follow-up, choose and specify the last follow-up) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition + infliximab groupInfliximab groupIntervention 3 groupBetween-group difference p-value (or 95% CI)aImpaired growth, n/N (%)NRNRNANADelay in pubertal development, n/N (%)NRNRNANABowel obstructionNRNRNANAFistulaeNRNRNANAAbscessNRNRNANAColon/bowel cancerNRNRNANAIntestinal infectionNRNRNANAOthers (specify)NRNRNANANA, not applicable; NR, not reported.a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). | Elemental nutrition + infliximab group | Infliximab group | Intervention 3 group | Between-group difference p-value (or 95% CI)a | Impaired growth, n/N (%) | NR | NR | NA | NA | Delay in pubertal development, n/N (%) | NR | NR | NA | NA | Bowel obstruction | NR | NR | NA | NA | Fistulae | NR | NR | NA | NA | Abscess | NR | NR | NA | NA | Colon/bowel cancer | NR | NR | NA | NA | Intestinal infection | NR | NR | NA | NA | Others (specify) | NR | NR | NA | NA | NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemental nutrition + infliximab group | Infliximab group | Intervention 3 group | Between-group difference p-value (or 95% CI)a | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Impaired growth, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Delay in pubertal development, n/N (%) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bowel obstruction | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fistulae | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Abscess | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Colon/bowel cancer | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Intestinal infection | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Others (specify) | NR | NR | NA | NA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NA, not applicable; NR, not reported. a RR, risk difference or MD (specify if it is between mean change values from baseline or between mean final end-point values). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Authors conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| After 56 weeks of follow-up, the effect of addition of elemental nutrition to infliximab was not statistically significant for the maintenance of remission rate and CDAI scores | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reviewer’s conclusion | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Assignment depended on compliance, i.e. patients with good compliance were assigned to elemental nutrition group and those with low compliance to infliximab alone group. The maintenance rates of clinical remission and CDAI scores were not significantly different between the elemental nutrition and control groups after 56 weeks of follow-up; age and gender did not significantly modify the observed effect of elemental nutrition on the maintenance of remission rates | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Appendix 3 The risk of bias assessment of included primary study reports
Randomised controlled trials
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Paul Sutcliffe
First author surname year of publication: Hanai 201250
| Bias domain | Source of bias | Support for judgementa | Authors’ judgementb | |
|---|---|---|---|---|
| Selection bias | Random sequence generation | Group assignment was done by a random process | Low RoB | |
| Allocation concealment | No information provided | Unclear RoB | ||
| Performance bias | Blinding of participants and personnel | Subjective (e.g. patient reported) | No information provided, but probably not blinded; their knowledge of the treatment likely to influence the outcome reporting | High RoB |
| Objective (e.g. radiography, endoscopy) | Although participants and personnel not blinded, their knowledge of the treatment is unlikely to have influenced the outcome reporting | Low RoB | ||
| Detection bias | Blinding of outcome assessors | Subjective (e.g. patient reported) | No information provided, but, even if blinded, the reporting of subjective outcomes may have already been influenced | High RoB |
| Objective (e.g. radiography, endoscopy) | Even if not blinded, the assessment of objective outcomes is unlikely to have been influenced | Low RoB | ||
| Attrition bias | Incomplete outcome data | Subjective outcomes (e.g. patient reported) | Although there were 11 withdrawals, the assessed data were complete (no missing outcomes) | Low RoB |
| Objective outcomes (e.g. radiography, endoscopy) | Although there were 11 withdrawals, the assessed data were complete (no missing outcomes) | Low RoB | ||
| Reporting bias | Selective reporting of the outcome, subgroups or analysis | Cumulative probability (survival) of maintaining remission incompletely reported (only p-values) | High RoB | |
| Other bias | Funding source, adequacy of statistical methods used, type of analysis (ITT/PP), baseline imbalance in important characteristics | No serious issues detected (funding source not reported, statistical methods adequate, no major baseline imbalance across the study groups) | Low RoB | |
Summary assessment of the within-study RoB for an outcome across domains
| Outcome measure | SRoB across all domains within a study |
|---|---|
| Subjective (list of outcomes): maintenance of remission (e.g. CDAI score of < 150 points), occurrence of relapse/recurrence (e.g. CDAI score of ≥ 150 points), time to relapse/recurrence (e.g. CDAI score of ≥ 150 points), QoL measures, clinical scores of severity (e.g. CDAI score) | Maintenance of remission (CDAI score of < 150 points): high RoB |
| Objective (list of outcomes): maintenance of remission (includes additional objective parameters besides clinical), occurrence of relapse/recurrence (includes additional objective parameters besides clinical), time to relapse/recurrence (includes additional objective parameters besides clinical), mucosal healing (endoscopic remission), weight gain, linear growth rate, complications, adverse events, adherence | Occurrence of relapse/recurrence (CDAI score of ≥ 200 points or the need for an additional medication to suppress worsening symptoms), need for surgery, adverse events: low RoB |
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Paul Sutcliffe
First author surname year of publication: Takagi 2006,52,53 Takagi 200954
| Bias domain | Source of bias | Support for judgementa | Authors’ judgementb | |
|---|---|---|---|---|
| Selection bias | Random sequence generation | ‘A block randomization (block size = 10) was made with a random number table, and it was stratified into three groups according to the frequency of relapse’52 | Low RoB | |
| Allocation concealment | ‘Randomized allocation was performed independently of the two clinical centres by the randomization centre’52 | Low RoB | ||
| Performance bias | Blinding of participants and personnel | Subjective (e.g. patient reported) | Participants and personnel were not blinded; their knowledge of the treatment is likely to have influenced the reporting of outcome | High RoB |
| Objective (e.g. radiography, endoscopy) | Although participants and personnel were not blinded, their knowledge of the treatment is unlikely to have influenced the reporting of outcome | Low RoB | ||
| Detection bias | Blinding of outcome assessors | Subjective (e.g. patient reported) | Blinded (see below), but subjective outcomes may have been already influenced since patients and personnel were not blinded | High RoB |
| Objective (e.g. radiography, endoscopy) | ‘To maintain the blinding of the principal investigators at each site, the results of the laboratory tests and the CDAI were reviewed by co-investigators who had no contact with patients, and these results were reported in a separate case report form’52 | Low RoB | ||
| Attrition bias | Incomplete outcome data | Subjective outcomes (e.g. patient reported) | No missing outcome data | Low RoB |
| Objective outcomes (e.g. radiography, endoscopy) | No missing outcome data | Low RoB | ||
| Reporting bias | Selective reporting of the outcome, subgroups or analysis | Remission rates not reported | High RoB | |
| Other bias | Funding source, adequacy of statistical methods used, type of analysis (ITT/PP), baseline imbalance in important characteristics | No serious issues detected (i.e. no external funding received, statistical methods adequate, ITT analysis, no major baseline imbalance between the study groups) | Low RoB | |
Summary assessment of the within-study RoB for an outcome across domains
| Outcome measure | SRoB across all domains within a study |
|---|---|
| Subjective (list of outcomes): maintenance of remission (e.g. CDAI score of < 150 points), occurrence of relapse/recurrence (e.g. CDAI score of ≥ 150 points), time to relapse/recurrence (e.g. CDAI score of ≥ 150 points), QoL measures, clinical scores of severity (e.g. CDAI score) | QoL measure (IBDQ): high RoB |
| Objective (list of outcomes): maintenance of remission (includes additional objective parameters besides clinical), occurrence of relapse/recurrence (includes additional objective parameters besides clinical), time to relapse/recurrence (includes additional objective parameters besides clinical), mucosal healing (endoscopic remission), weight gain, linear growth rate, complications, adverse events, adherence | Occurrence of relapse/recurrence (CDAI score of > 200 points or the need for therapy to induce remission), adherence, adverse events: low RoB |
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Paul Sutcliffe
First author surname year of publication: Verma 200155
| Bias domain | Source of bias | Support for judgementa | Authors’ judgementb | |
|---|---|---|---|---|
| Selection bias | Random sequence generation | No information provided | Unclear RoB | |
| Allocation concealment | No information provided | Unclear RoB | ||
| Performance bias | Blinding of participants and personnel | Subjective (e.g. patient reported) | No information provided, but probably not blinded; their knowledge of the treatment likely to influence the outcome reporting | High RoB |
| Objective (e.g. radiography, endoscopy) | Although participants and personnel not blinded, their knowledge of the treatment would not influence the outcome reporting | Low RoB | ||
| Detection bias | Blinding of outcome assessors | Subjective (e.g. patient reported) | No information provided, but even if blinded, the reporting of subjective outcomes may have already been influenced | High RoB |
| Objective (e.g. radiography, endoscopy) | No information provided, but even if not blinded the assessment of objective outcomes unlikely to be influenced | Low RoB | ||
| Attrition bias | Incomplete outcome data | Subjective outcomes (e.g. patient reported) | Although there were 6 (18%) withdrawals, the analysed data were complete (no missing outcome) | Low RoB |
| Objective outcomes (e.g. radiography, endoscopy) | Although there were 6 (18%) withdrawals, the analysed data were complete (no missing outcome) | Low RoB | ||
| Reporting bias | Selective reporting of the outcome, subgroups or analysis | Outcomes were not pre-specified in methods section, only in the abstract; need for surgery was not reported in results section; selective reporting likely | High RoB | |
| Other bias | Funding source, adequacy of statistical methods used, type of analysis (ITT/PP), baseline imbalance in important characteristics | No funding reported; statistical analyses adequate; there was some imbalance in the elemental nutrition group being on steroids for shorter period, higher CDAI score and lower weight than the control group | Unclear RoB | |
Summary assessment of the within-study RoB for an outcome across domains
| Outcome measure | SRoB across all domains within a study |
|---|---|
| Subjective (list of outcomes): maintenance of remission (e.g. CDAI score of < 150 points), occurrence of relapse/recurrence (e.g. CDAI score of ≥ 150 points), time to relapse/recurrence (e.g. CDAI score of ≥ 150 points), QoL measures, clinical scores of severity (e.g. CDAI score) | Occurrence of relapse/recurrence (CDAI score of ≥ 200 points or increased by 100 points from baseline): high RoB |
| Objective (list of outcomes): maintenance of remission (includes additional objective parameters besides clinical), occurrence of relapse/recurrence (includes additional objective parameters besides clinical), time to relapse/recurrence (includes additional objective parameters besides clinical), mucosal healing (endoscopic remission), weight gain, linear growth rate, complications, adverse events, adherence | Maintenance of remission (absence of diarrhoea and abdominal pain, CDAI score of ≤ 150 points in the 2 weeks preceding the study and ESR < 20 mm/hour), withdrawal from steroids, adherence: unclear RoB |
Non-randomised controlled trials
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Paul Sutcliffe
First author surname year of publication: Hirakawa 199351
| Bias domain | Source of bias | Support for judgementa | Authors’ judgementb | |
|---|---|---|---|---|
| Selection bias | The presence/absence of baseline between-group imbalance in important prognostic characteristics/factors (e.g. age, gender, CDAI score, duration of CD, location of CD, complications during induction therapy, type of induction therapy, pre-study compliance, co-intervention, and/or smoking) | There was some imbalance in induction therapy and distribution of lesion across the study groups | High RoB | |
| Performance bias | Blinding of participants and Personnel | Subjective (e.g. patient reported) | Pure subjective outcomes: NR. No information on blinding but probably not blinded | NA |
| Objective (e.g. radiography, endoscopy) | No information on blinding but probably not blinded. However, given the objective outcomes their knowledge of the treatment would not influence the outcome reporting | Low RoB | ||
| Detection bias | Blinding of outcome assessors | Subjective (e.g. patient reported) | Pure subjective outcomes: NR. No information on blinding but probably not blinded | NA |
| Objective (e.g. radiography, endoscopy) | No information on blinding but probably not blinded. However, given the objective outcomes their knowledge of the treatment would not influence the outcome reporting | Low RoB | ||
| Attrition bias | Incomplete outcome data | Subjective outcomes (e.g. patient reported) | Pure subjective outcomes: NR | NA |
| Objective outcomes (e.g. radiography, endoscopy) | Eight patients were excluded from the analyses (incomplete outcome data) | High RoB | ||
| Reporting bias | Selective reporting of the outcome, subgroups or analysis | The analyses for survival of remission, remission maintenance rates and relapse rates were incompletely reported (no or partial numerical data) | High RoB | |
| Other bias | Funding source, adequacy of statistical methods used, type of analysis (ITT/PP) | Funding source not stated, PP analysis instead of ITT, possible imbalance in unmeasured prognostic factors | High RoB | |
Summary assessment of the within-study RoB for an outcome across domains
| Outcome measure | SRoB across all domains within a study |
|---|---|
| Subjective (list of outcomes): maintenance of remission (e.g. CDAI score of < 150 points), occurrence of relapse/recurrence (e.g. CDAI score of ≥ 150 points), time to relapse/recurrence (e.g. CDAI score of ≥ 150 points), QoL measures, clinical scores of severity (e.g. CDAI score) | NR (see below): NA |
| Objective (list of outcomes): maintenance of remission (includes additional objective parameters besides clinical), occurrence of relapse/recurrence (includes additional objective parameters besides clinical), time to relapse/recurrence (includes additional objective parameters besides clinical), mucosal healing (endoscopic remission), weight gain, linear growth rate, complications, adverse events, adherence | Maintenance of remission (cumulative survival): high RoB. Adherence: low RoB |
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Paul Sutcliffe
First author surname year of publication: Verma 200056
| Bias domain | Source of bias | Support for judgementa | Authors’ judgementb | |
|---|---|---|---|---|
| Selection bias | The presence/absence of baseline between-group imbalance in important prognostic characteristics/factors (e.g. age, gender, CDAI score, duration of CD, location of CD, complications during induction therapy, type of induction therapy, pre-study compliance, co-intervention and/or smoking) | The elemental nutrition group had shorter disease duration (60.3 vs. 91.0 months), greater ESR and longer steroid use than control group | High RoB | |
| Performance bias | Blinding of participants and personnel | Subjective (e.g. patient reported) | No information on blinding but probably not blinded; their knowledge of the treatment likely to influence the outcome reporting | High RoB |
| Objective (e.g. radiography, endoscopy) | No information on blinding but probably not blinded. However, given the objective outcomes their knowledge of the treatment would not influence the outcome reporting | Low RoB | ||
| Detection bias | Blinding of outcome assessors | Subjective (e.g. patient reported) | No information on blinding; the reporting of subjective outcomes may have already been influenced | High RoB |
| Objective (e.g. radiography, endoscopy) | No information on blinding; however, given the objective outcomes their knowledge of the treatment would not influence the outcome reporting | Low RoB | ||
| Attrition bias | Incomplete outcome data | Subjective outcomes (e.g. patient reported) | Complete data analysed | Low RoB |
| Objective outcomes (e.g. radiography, endoscopy) | Complete data analysed | Low RoB | ||
| Reporting bias | Selective reporting of the outcome, subgroups or analysis | No pre-specification of outcomes (methods section) | High RoB | |
| Other bias | Funding source, adequacy of statistical methods used, type of analysis (ITT/PP) | No funder reported, statistical analyses adequate, ITT used | Low RoB | |
Summary assessment of the within-study RoB for an outcome across domains
| Outcome measure | SRoB across all domains within a study |
|---|---|
| Subjective (list of outcomes): maintenance of remission (e.g. CDAI score of < 150 points), occurrence of relapse/recurrence (e.g. CDAI score of ≥ 150 points), time to relapse/recurrence (e.g. CDAI score of ≥ 150 points), QoL measures, clinical scores of severity (e.g. CDAI score) | Maintenance of remission (CDAI score of < 150 points), CDAI score: high RoB |
| Objective (list of outcomes): maintenance of remission (includes additional objective parameters besides clinical), occurrence of relapse/recurrence (includes additional objective parameters besides clinical), time to relapse/recurrence (includes additional objective parameters besides clinical), mucosal healing (endoscopic remission), weight gain, linear growth rate, complications, adverse events, adherence | Occurrence of relapse/recurrence (increase in CDAI score by > 100 points since baseline or final CDAI score of > 150 points; need of surgery; increased doses of steroids), time to relapse, adherence, steroid dose tapering, withdrawal from steroids, adverse events: unclear RoB |
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Paul Sutcliffe
First author surname year of publication: Yamamoto 2007,28 Yamamoto 201359,60
| Bias domain | Source of bias | Support for judgementa | Authors’ judgementb | |
|---|---|---|---|---|
| Selection bias | The presence/absence of baseline between-group imbalance in important prognostic characteristics/factors (e.g. age, gender, CDAI score, duration of CD, location of CD, complications during induction therapy, type of induction therapy, pre-study compliance, co-intervention and/or smoking) | No major imbalance between the study groups in the pre-specified important prognostic factors. However, patients with good compliance were assigned to elemental nutrition group and those with low compliance to no treatment group; this selective assignment may have generated differences between the groups in not otherwise pre-specified factors | Unclear RoB | |
| Performance bias | Blinding of participants and personnel | Subjective (e.g. patient reported) | Not blinded; subjective, i.e. patient-reported outcomes reporting likely influenced | High RoB |
| Objective (e.g. radiography, endoscopy) | Not blinded; objective outcomes reporting unlikely to be influenced | Low RoB | ||
| Detection bias | Blinding of outcome assessors | Subjective (e.g. patient reported) | No information; regardless of blinding status, subjective, i.e. patient-reported outcomes reporting likely influenced | High RoB |
| Objective (e.g. radiography, endoscopy) | Endoscopic investigators were blind to patient status; objective outcomes assessment unlikely to be influenced | Low RoB | ||
| Attrition bias | Incomplete outcome data | Subjective outcomes (e.g. patient reported) | Outcomes for all patients available (complete data analysed) | Low RoB |
| Objective outcomes (e.g. radiography, endoscopy) | Outcomes for all patients available (complete data analysed) | Low RoB | ||
| Reporting bias | Selective reporting of the outcome, subgroups or analysis | Main outcomes pre-specified (methods section) and reported | Low RoB | |
| Other bias | Funding source, adequacy of statistical methods used, type of analysis (ITT/PP) | No external funding received; statistical methods adequate; ITT analysis done | Low RoB | |
Summary assessment of the within-study RoB for an outcome across domains
| Outcome measure | SRoB across all domains within a study |
|---|---|
| Subjective (list of outcomes): maintenance of remission (e.g. CDAI score of < 150 points), occurrence of relapse/recurrence (e.g. CDAI score of ≥ 150 points), time to relapse/recurrence (e.g. CDAI score of ≥ 150 points), QoL measures, clinical scores of severity (e.g. CDAI score) | Maintenance of remission (CDAI score of < 150 points), occurrence of relapse/recurrence (CDAI score of ≥ 150 points, CDAI score of ≥ 200 points): high RoB |
| Objective (list of outcomes): maintenance of remission (includes additional objective parameters besides clinical), occurrence of relapse/recurrence (includes additional objective parameters besides clinical), time to relapse/recurrence (includes additional objective parameters besides clinical), mucosal healing (endoscopic remission), weight gain, linear growth rate, complications, adverse events, adherence | Occurrence of relapse/recurrence (Rutgeerts score ≥ 2), adherence, need for surgery: low RoB |
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Paul Sutcliffe
First author surname year of publication: Yamamoto 200757
| Bias domain | Source of bias | Support for judgementa | Authors’ judgementb | |
|---|---|---|---|---|
| Selection bias | The presence/absence of baseline between-group imbalance in important prognostic characteristics/factors (e.g. age, gender, CDAI score, duration of CD, location of CD, complications during induction therapy, type of induction therapy, pre-study compliance, co-intervention, and/or smoking) | No major imbalance between the study groups in the pre-specified important prognostic factors. However, patients with good compliance were assigned to the elemental nutrition group and those with low compliance to the no treatment group; this selective assignment may have generated differences between the groups in not otherwise pre-specified factors | Unclear RoB | |
| Performance bias | Blinding of participants and personnel | Subjective (e.g. patient reported) | Not blinded; the knowledge of the treatment could have influenced the outcome recording | High RoB |
| Objective (e.g. radiography, endoscopy) | Not blinded; the knowledge of the treatment would not have influenced the outcome recording | Low RoB | ||
| Detection bias | Blinding of outcome assessors | Subjective (e.g. patient reported) | Lab investigators were blinded to the clinical data; however, the collected patient-reported outcome data may have already been influenced | High RoB |
| Objective (e.g. radiography, endoscopy) | Lab investigators were blinded to the clinical data; the blinding status was unlikely to influence the outcome assessment | Low RoB | ||
| Attrition bias | Incomplete outcome data | Subjective outcomes (e.g. patient reported) | Outcome data for all patients were available | Low RoB |
| Objective outcomes (e.g. radiography, endoscopy) | Outcome data for all patients were available | Low RoB | ||
| Reporting bias | Selective reporting of the outcome, subgroups or analysis | All pre-specified outcomes (methods) were reported (results) | Low RoB | |
| Other bias | Funding source, adequacy of statistical methods used, type of analysis (ITT/PP) | No funding reported; analyses were adequate; ITT analysis done | Low RoB | |
Summary assessment of the within-study RoB for an outcome across domains
| Outcome measure | Summary RoB across all domains within a study |
|---|---|
| Subjective (list of outcomes): maintenance of remission (e.g. CDAI score of < 150 points), occurrence of relapse/recurrence (e.g. CDAI score of ≥ 150 points), time to relapse/recurrence (e.g. CDAI score of ≥ 150 points), QoL measures, clinical scores of severity (e.g. CDAI score) | Maintenance of remission (CDAI score of < 150 points), occurrence of relapse/recurrence (CDAI score of ≥ 150 points), CDAI score: high RoB |
| Objective (list of outcomes): maintenance of remission (includes additional objective parameters besides clinical), occurrence of relapse/recurrence (includes additional objective parameters besides clinical), time to relapse/recurrence (includes additional objective parameters besides clinical), mucosal healing (endoscopic remission), weight gain, linear growth rate, complications, adverse events, adherence | Mucosal healing (endoscopic remission), weight, BMI, adherence, need for surgery: low RoB |
Name of first reviewer: Alexander Tsertsvadze
Name of second reviewer: Paul Sutcliffe
First author surname year of publication: Yamamoto 201058
| Bias domain | Source of bias | Support for judgementa | Authors’ judgementb | |
|---|---|---|---|---|
| Selection bias | The presence/absence of baseline between-group imbalance in important prognostic characteristics/factors (e.g. age, gender, CDAI score, duration of CD, location of CD, complications during induction therapy, type of induction therapy, pre-study compliance, co-intervention, and/or smoking) | No major imbalance between the study groups in the pre-specified important prognostic factors. However, patients with good compliance were assigned to elemental nutrition group and those with low compliance to infliximab alone group; this selective assignment may have generated differences between the groups in not otherwise pre-specified factors | Unclear RoB | |
| Performance bias | Blinding of participants and personnel | Subjective (e.g. patient reported) | No information provided, but probably not blinded; their knowledge of the treatment likely to influence the outcome reporting | High RoB |
| Objective (e.g. radiography, endoscopy) | Although participants and personnel not blinded, their knowledge of the treatment would not influence the outcome reporting | Low RoB | ||
| Detection bias | Blinding of outcome assessors | Subjective (e.g. patient reported) | No information provided, but even if blinded, the reporting of subjective outcomes may have already been influenced | High RoB |
| Objective (e.g. radiography, endoscopy) | No information provided, but even if not blinded the assessment of objective outcomes unlikely to be influenced | Low RoB | ||
| Attrition bias | Incomplete outcome data | Subjective outcomes (e.g. patient reported) | The analysed data were complete (no missing outcome) | Low RoB |
| Objective outcomes (e.g. radiography, endoscopy) | The analysed data were complete (no missing outcome) | Low RoB | ||
| Reporting bias | Selective reporting of the outcome, subgroups or analysis | All pre-specified (in methods section) outcomes were reported (in results section) | Low RoB | |
| Other bias | Funding source, adequacy of statistical methods used, type of analysis [ITT/PP] | No funding reported; statistical analyses adequate; ITT analysis reported | Low RoB | |
Summary assessment of the within-study RoB for an outcome across domains
| Outcome measure | Summary RoB across all domains within a study |
|---|---|
| Subjective (list of outcomes): maintenance of remission (e.g. CDAI score of < 150 points), occurrence of relapse/recurrence (e.g. CDAI score of ≥ 150 points), time to relapse/recurrence (e.g. CDAI score of ≥ 150 points), QoL measures, clinical scores of severity (e.g. CDAI score) | Maintenance of remission (CDAI score of < 150 points), occurrence of relapse/recurrence (e.g. CDAI score of ≥ 150 points), clinical scores of severity (CDAI score): high RoB |
| Objective (list of outcomes): maintenance of remission (includes additional objective parameters besides clinical), occurrence of relapse/recurrence (includes additional objective parameters besides clinical), time to relapse/recurrence (includes additional objective parameters besides clinical), mucosal healing (endoscopic remission), weight gain, linear growth rate, complications, adverse events, adherence | Adherence: low RoB |
Appendix 4 Studies excluded with reasons
| Study | Reason for exclusion |
|---|---|
| Belli DC, Seidman E, Bouthillier L, Weber AM, Roy CC, Pletincx M, et al. Chronic intermittent elemental diet improves growth failure in children with Crohn’s disease. Gastroenterology 1988;94:603–10 | < 80% participants in remission |
| Cucchiara S, Guandalini S, Staiano A, Ferola A, Romaniello G, Latte F, et al. Remission of colonic crohns-disease induced by elemental diet. Ital J Gastroenterol 1984;16:302–4 | Case report |
| Esaki M, Matsumoto T, Hizawa K, Nakamura S, Jo Y, Mibu R, et al. Preventive effect of nutritional therapy against postoperative recurrence of Crohn disease, with reference to findings determined by intra-operative enteroscopy. Scand J Gastroenterol 2005;40:1431–7 | Unclear control group |
| Fukuda Y, Okui M, Tamura K, Shimoyama T. Serum fatty acid and disease activity in Crohn's disease patients during maintenance therapy with elemental diet. JPEN 1999;23:S135 | Irrelevant treatment/outcome |
| Geerling BJ, Badart-Smook A, van Deursen C, van Houwelingen AC, Russel M, Stockbrugger RW, et al. Nutritional supplementation with n-3 fatty acids and antioxidants in patients with Crohn’s disease in remission: Effects on antioxidant status and fatty acid profile. Inflamm Bowel Dis 2000;6:77–84 | Irrelevant treatment/outcome |
| Gorard DA, Hunt JB, Payne-James JJ, Palmer KR, Kumar PJ, Clark ML, et al. Relapse rates in Crohn’s disease after initial treatment with elemental diet or prednisolone. Gut 1991;32:A582 | Abstract |
| Harries AD, Jones LA, Danis V, Fifield R, Heatley RV, Newcombe RG, et al. Controlled trial of supplemented oral nutrition in Crohn’s disease. Lancet 1983;1:887–90 | Participants with active CD |
| Herzog D, Deslandres C, Martin S, Rasquin A, Alvarez F, Bouthillier L, et al. Cyclical exclusive semi-elemental diet therapy normalises growth and decreases relapse rate in paediatric Crohn’s disease. Gastroenterology 1997;112:A995 | Abstract |
| Hunt JB, Payne-James JJ. A randomised controlled trial of elemental diet versus prednisolone in treatment of new and recurrent Crohn's disease. Clin Sci 1989;77(Suppl. 21):26 | Abstract |
| Hunt JB, Payne-James JJ, Palmer KR, Kumar PK, Clark ML, Farthing MJ, et al. A randomised controlled trial of elemental diet versus prednisolone in the treatment of new and recurrent Crohn’s disease. Clin Nutr 1989;8(Spec. Suppl.):80 | Abstract |
| Imes S, Pinchbeck B, Dinwoodie A, Walker K, Thomson AB. Effect of Ensure, a defined formula diet, in patients with Crohn’s disease. Digestion 1986;35:158–69 | Participants with active CD |
| Kamata N, Watanabe K, Tsukahara T, Hagihara Y, Morimoto K, Noguchi A, et al. Concomitant elemental diet therapy is effective in sustaining infliximab scheduled maintenance therapy in patients with Crohn’s disease to prevent loss of response. Gastroenterology 2013;1:S433 | Abstract |
| Matsui T, Ueki M, Yamada M, Sakurai T, Yao T. Indications and options of nutritional treatment for Crohn's disease. A comparison of elemental and polymeric diets. J Gastroenterol 1995;30(Suppl. 8):95–7 | Abstracts of three studies |
| Otley AR, Murray A, Christensen B, Williams T, Ste-Marie M, Rashid M. Primary enteral nutrition therapy induces and maintains remission, and reduces steroid exposure in a paediatric Crohn’s disease population. Gastroenterology 2005;128:A584 | Abstract |
| Papadopoulou A, Rawashdeh MO, Brown GA, McNeish AS, Booth IW. Remission following an elemental diet or prednisolone in Crohn’s disease. Acta Paediatr 1995;84:79–83 | Retrospective (cohort) study |
| Roggero P, Santus F, Barabino A, Canani RB, Cucchiara S, Guariso G, et al. A prospective pediatric multicenter trial of enteral nutrition and azathioprine in preventing relapses of Crohn disease: preliminary results. J Pediatr Gastroenterol Nutr 2003;36:543 | Abstract |
| Shoda R, Yamato S. Comparison of therapeutic efficacy of elemental and polymeric enteral nutrition in the patients with quiescent Crohn’s disease: a pilot cross-over trial. Gastroenterology 2007;132:A523 | Abstract |
| Takahashi S, Takagi S, Shiga H, Umemura K, Endo K, Kakuta Y, et al. Scheduled maintenance therapy with infliximab improves the prognosis of Crohn’s disease: a single centre prospective cohort study in Japan. Tohoku J Exp Med 2010;220:207–15 | Retrospective (cohort) study |
| Vaisman N, Griffiths A, Pencharz PB. Comparison of nitrogen utilisation of two elemental diets in patients with Crohn’s disease. J Pediatr Gastroenterol Nutr 1988;7:84–8 | Unclear population/control group |
| Watanabe O, Ando T, Ishiguro K, Takahashi H, Ishikawa D, Miyake N, et al. Enteral nutrition decreases hospitalisation rate in patients with Crohn’s disease. J Gastroenterol Hepatol 2010;25(Suppl. 1):S134–7 | Retrospective (cohort) study |
| Wierdsma NJ, Van Bodegraven AA, Uitdehaag BMJ, Arjaans W, Savelkoul PHM, Kruizenga HM, et al. Fructo-oligosaccharides and fibre in enteral nutrition has a beneficial influence on microbiota and gastrointestinal quality of life. Scand J Gastroenterol 2009;44:804–12 | Head and neck cancer patients |
| Woolner JT, Parker TJ, Kirby GA, Hunter JO. The development and evaluation of a diet for maintaining remission in Crohn’s disease. J Hum Nutr Diet 1998;11:1–11 | Irrelevant treatment/outcome |
| Yamamoto T, Shiraki M. Efficacy of enteral nutrition during infliximab maintenance therapy in patients with Crohn’s disease. Dig Dis Sci 2013;58:1802–3 | Comment |
| Yoshida K, Fukunaga K, Ikeuchi H, Kamikozuru K, Yokoyama Y, Hida N, et al. Infliximab mono-therapy prevented post operative recurrence of Crohn’s disease after intestinal resection: a prospective randomised open trial in Japanese population. Gastroenterology 2010;1:S691 | Abstract |
Glossary
- Elemental nutrition
- A liquid monomeric amino acid-based formula, which contains individual amino acids, glucose polymers, and is low in fat, with about 2–3% of calories derived from long-chain triglycerides. Elemental nutrition formula does not contain antigens.
- Enteral nutrition
- A method of delivering nourishment through a tube placed in the nose (nasogastric or nasoenteral tube), the stomach (gastrostomy or percutaneous endoscopic gastrostomy tube) or the small intestine (jejunostomy or percutaneous endoscopic jejunostomy tube). Enteral nutrition varies in the protein and fat content and can be classified as elemental, semi-elemental, polymeric or specialised.
- Parenteral nutrition
- Feeding via the bloodstream intravenously.
- Polymeric nutrition
- A liquid whole-protein-based formula that contains intact proteins (sources: milk, meat, egg, soy), complex carbohydrates and mainly long-chain triglycerides.
- Semi-elemental nutrition
- A liquid oligopeptide formula that contains peptides of various chain lengths, simple sugars, glucose polymers or starch and fat, mainly as medium-chain triglycerides.
- Specialised nutrition
- A liquid formula that contains biologically active substances or nutrients such as glutamine, arginine, nucleotides or essential fatty acids.
- Total parenteral nutrition
- Feeding solely via the intravenous route.
List of abbreviations
- 5-ASA
- 5-aminosalicylic acid
- 6-MP
- 6-mercaptopurine
- BMI
- body mass index
- CCT
- controlled clinical trial
- CD
- Crohn’s disease
- CDAI
- Crohn’s Disease Activity Index
- CI
- confidence interval
- CRP
- C-reactive protein
- EEN
- exclusive enteral nutrition
- ESR
- erythrocyte sedimentation rate
- GRADE
- Grading of Recommendations, Assessment, Development, and Evaluation
- HRQoL
- health-related quality of life
- IBD
- inflammatory bowel disease
- IBDQ
- Inflammatory Bowel Disease Questionnaire
- IOIBD
- International Organisation for the Study of Inflammatory Bowel Disease
- LCT
- long-chain triglyceride
- MD
- mean difference
- MeSH
- medical subject heading
- NICE
- National Institute for Health and Care Excellence
- nRCT
- non-randomised controlled trial
- OR
- odds ratio
- PEN
- partial enteral nutrition
- QoL
- quality of life
- RCT
- randomised controlled trial
- RoB
- risk of bias
- RR
- risk ratio
- SD
- standard deviation
- SMR
- standardised mortality ratio
- SRoB
- summary risk of bias
- TNF
- tumour necrosis factor
- UKCRN
- UK Clinical Research Network
- WHO ICTRP
- World Health Organization International Clinical Trials Registry Platform